2. 天津中医药大学, 天津 300193
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
苦豆子多糖是由豆科槐属植物苦豆子Sophora alopecuroides L.的种子中提取得到的多糖,其主要成分为半乳甘露聚糖,可作为增稠剂、稳定剂和生物材料而广泛应用于食品、医药、造纸等行业[1, 2, 3]。目前,苦豆子多糖的提取分离以及纯化工艺已经有了系统的研究,并得到质量稳定的苦豆子多糖[4, 5, 6, 7, 8]。在此基础上,为了增强该多糖的活性,进行了硫酸化、磷酸化以及羧甲基化等一系列的衍生化,并研究各个衍生物的抗氧化活性[9, 10, 11]。目前,有关苦豆子多糖的研究尚未涉及到溶液行为及构象,而多糖的立体构象对于多糖的生产和活性研究有着重要意义[12, 13]。为了进一步开发利用苦豆子多糖,本实验研究了不同浓度、温度和金属离子等对其溶液构象的影响,为其临床应用和开发研究奠定基础。
1 材料Specord 210 Plus紫外可见分光光度计(德国耶拿分析仪器股份公司);Jasco J-715圆二色谱仪(日本Jasco公司)。
苦豆子多糖经本实验室提取纯化冷冻干燥而得(质量分数为98.9%);刚果红、氢氧化钠、氯化钙均为分析纯,均购自天津试剂开发公司。
2 方法与结果 2.1 苦豆子多糖链的分支情况配制质量浓度为1.0 mg/mL的苦豆子多糖溶液2.0 mL,加入1.2 mL碘试剂(含0.02 % I2的0.2% KI溶液),混匀后测定紫外吸收,观察紫外最大吸收的范围,见图 1。苦豆子多糖与碘试剂反应物的最大吸收峰在300~500 nm,而非565 nm,说明该多糖有较长的侧链和较多的分支[14]。
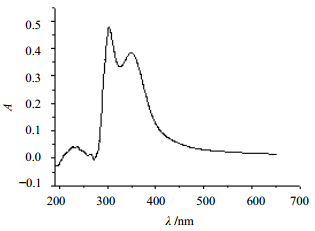 | 图 1 苦豆子多糖与碘试剂反应后的紫外可见吸收光谱图Fig. 1 UV spectrum of SAP after reaction with I2-KI |
刚果红是一种染料,可以与具有三股螺旋链的多糖形成络合物,络合物的最大吸收波长会发生红移,在一定的NaOH浓度范围内,表现为最大吸收波长的特征变化,当NaOH浓度大于某个浓度后,最大吸收波长急剧下降。
苦豆子多糖溶液质量浓度为1 mg/mL,刚果红溶液浓度为80 μmol/L,NaOH依次配成不同浓度(0.05~1.0 mol/L用邻苯二甲酸氢钾标定),将苦豆子多糖溶液、刚果红溶液、NaOH溶液按体积比1∶1∶2混合并摇匀,25 ℃下静置10 min后用紫外分光光度仪400~600 nm进行扫描,依次测定混合液在不同浓度NaOH下最大吸收波长的变化。
苦豆子多糖水溶液与刚果红形成的络合物在NaOH浓度0~0.5 mol/L最大吸收波长的变化见图 2。随着NaOH浓度的增大,刚果红被苦豆子多糖络合后变成紫红色,其络合物的最大吸收波长红移,在一定NaOH浓度范围内,络合物出现亚稳区,表明多糖分子存在多股螺旋构象,当NaOH浓度达到0.3 mol/L时,其最大吸收波长开始下降,当浓度达到0.4 mol/L时急剧下降到与对照相同,这种特征变化与张安强等[16]观察到的硫酸酯化猴头菌多糖的情况类似,这表明在中性、弱碱性范围内,苦豆子多糖是有序的三股螺旋结构,当碱的浓度达到0.4 mol/L时,解体为单股结构,不能与刚果红形成络合物,变成无规则的线团形式,从而使最大吸收波长骤降。
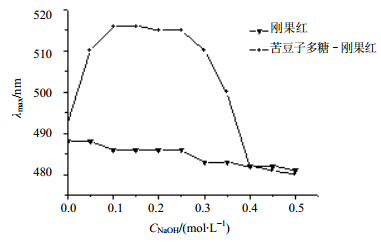 | 图 2 苦豆子多糖-刚果红络合物的最大吸收波长变化Fig. 2 Change of maximum absorption wavelength of SPA-Congo red complex |
将苦豆子多糖配制成1.0 mg/mL的溶液,波长范围190~300 nm,通过改变浓度、温度和添加Ca2+(3%CaCl2溶液)等因素观察苦豆子多糖溶液的圆二色谱(CD)变化,进而分析其构象的变化。
2.3.1 浓度的影响分别配制质量浓度为1.0、0.5 mg/mL苦豆子多糖水溶液,测定其圆二色谱,观察苦豆子多糖在不同浓度下溶液构象的转变,见图 3。由图 3-A可看出,苦豆子多糖在195 nm处有较大的正峰,质量浓度由1.0 mg/mL降低至0.5 mg/mL后,苦豆子多糖随着质量浓度降低,195 nm处吸收减弱,最大吸收位置没有改变;从图 3-B可看出,苦豆子多糖在230、270 nm处有正Cototn效应,且随着质量浓度的降低而减弱,这是由于苦豆子多糖具有有序的三股螺旋结构,随着质量浓度降低,氢键的作用减少,疏水作用增强,有序的状态减弱,多糖分子趋于聚解,手性减弱,空间构象发生了改变。
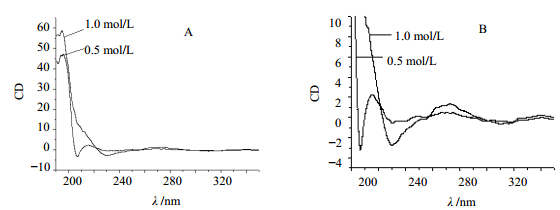 | 图 3 不同浓度的苦豆子多糖圆二色谱图(A)和部分放大图(B)Fig. 3 Effects of concentration on the CD spectrum (A) and local amplification (B) of SAP |
测定20、70 ℃下苦豆子多糖溶液的圆二色谱,观察苦豆子多糖在不同温度下溶液构象的转变,见图 4。195 nm处吸收强度随着温度升高而稍有增强和红移,提示温度升高到70 ℃后苦豆子多糖的手性略有增强。
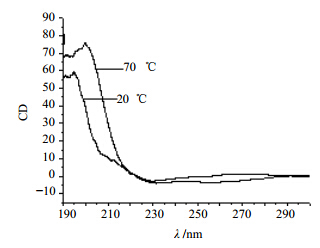 | 图 4 不同温度处理的苦豆子多糖的圆二色谱图Fig. 4 Effects of temperature on the CD of SAP |
苦豆子多糖在Ca2+水溶液中圆二色谱见图 5,结果表明其吸收峰增强和红移,推断苦豆子多糖分子间与Ca2+桥接或络合,发生胶化的过程中,形成“蛋箱”结构,导致分子的不对称性增强[18]。说明钙离子参与了苦豆子多糖的胶化过程,但作用较弱。
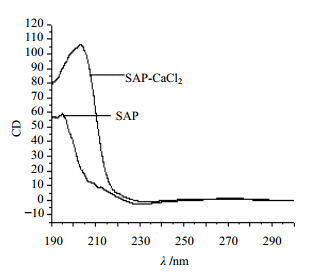 | 图 5 Ca2+处理的苦豆子多糖的圆二色谱Fig. 5 Effect Ca2+ of temperature on the CD of SAP |
多糖的活性与其构象有关,本研究中,刚果红实验结果表明苦豆子多糖具有三股螺旋结构,而三股螺旋结构具有较强的生物活性,其药理活性有待进一步研究。
通过观察几种不同因素(浓度、温度和钙离子)对苦豆子多糖溶液圆二色性的影响,研究苦豆子多糖在溶液中构象的变化,从其溶液行为的微观入手,为探讨构象转变和宏观性能的相关性提供参考。浓度、温度和钙离子因素对苦豆子多糖溶液的空间构象均有不同程度的影响,主要表现在吸收强度的变化。金属阳离子通过配位作用会对多糖的结构造成显著影响,常见的如Ca2+与海藻胶[19]、桔皮果胶形成“蛋箱”结构[20],因此,通过在多糖溶液中添加金属离子,检测其CD谱的变化,可以为多糖的结构提供更多信息。苦豆子多糖分子与Ca2+能形成“蛋箱”结构,导致分子的不对称性增强。研究苦豆子多糖在不同环境因素下的构象的变化,为苦豆子多糖的优势构象和构效关系研究提供理论依据,同时也为进一步临床应用和奠定理论基础。
多糖的空间构象研究较蛋白复杂,不能以简单的α-螺旋或β-折叠来描述,从糖类化合物CD的形状和强度,仍可以了解到寡糖(或多糖)的一级结构和空间构象等方面的结构信息,甚至可以作为糖类化合物结构变化的一种检测手段。另一方面,CD谱只能作为判断多糖溶液行为的一个论据,要得到更多的信息还需要结合其他技术手段,如NMR、X射线以及分子模拟等手段共同论证。
| [1] | 叶文斌, 樊 亮. 苦豆子多糖复合涂膜对成县樱桃贮藏品质的影响 [J]. 甘肃农业大学学报, 2013, 48(3): 62-67. |
| [2] | Buritia F C A, Freitasc S C, Egitoa A S, et al. Effects of tropical fruit pulps and partially hydrolysed galactomannan from Caesalpinia pulcherrima seeds on the dietary fibre content, probiotic viability, texture and sensory features of goat dairy beverages [J]. LWT-Food Sci Tech, 2014, 59(1): 196-203. |
| [3] | 叶文斌, 樊 亮, 王都留, 等. 苦豆子半乳甘露聚糖与中草药复合膜的包装性能研究 [J]. 包装与食品机械, 2012, 30(6): 10-14. |
| [4] | 艾连中. 响应面分析法优化苦豆子多糖提取工艺 [J]. 食品科学, 2010, 31(12): 141-143. |
| [5] | 陶遵威, 张 岩, 王文彤. 大孔吸附树脂对苦豆子多糖纯化工艺研究 [J]. 现代药物与临床, 2013, 28(4): 515-518. |
| [6] | 张 岩, 马丽娜, 王 鹏, 等. 苦豆子多糖脱蛋白工艺比较 [J]. 中国新药杂志, 2012, 21(8): 85-89. |
| [7] | 郑 夺, 张 岩, 王文彤, 等. 响应面分析法优化苦豆子多糖的醇沉工艺 [J]. 中国实验方剂学杂志, 2013, 19(16): 27-29. |
| [8] | 王文彤, 张 岩, 陶遵威. 正交试验优化苦豆子多糖的双氧水脱色工艺研究 [J]. 现代药物与临床, 2014, 29(11): 1234-1237. |
| [9] | 赵永安, 郑晓辉, 张 岩, 等. 苦豆子多糖硫酸化修饰工艺的研究 [J]. 中南药学, 2012, 10(8): 580-583. |
| [10] | 赵永安, 陈 冠, 陶遵威. 苦豆子多糖及其衍生物的体外抗氧化活性研究 [J]. 中国实验方剂学杂志, 2013, 19(5): 213-216. |
| [11] | 申林卉, 刘丽侠, 陈 冠, 等. 苦豆子多糖羧甲基化修饰及其抗氧化活性的研究 [J]. 天津中医药大学学报, 2014, 33(3): 157-160. |
| [12] | Gilbert H J, Knox J P, Boraston A B. Advances in understanding the molecular basis of plant cell wall polysaccharide recognition by carbohydrate-binding modules [J]. Curr Opin Struct Biol, 2013, 23(5): 669-677. |
| [13] | 田 华, 张义明. 多糖的结构测定及应用 [J]. 中国食品添加剂, 2012(2): 177-181. |
| [14] | 李志孝, 刘方明, 孟延发. 鬼臼葡聚糖的化学结构 [J]. 化学学报, 1996, 54(10): 1037-1040. |
| [15] | Yang W J, Pei F, Shi Y, et al. Purification, characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes [J]. Carbohyd Polym, 2012, 88(2): 474-480. |
| [16] | 张安强, 马 新, 何荣军, 等. 硫酸酯化猴头菌多糖的结构与构象分析 [J]. 食品与发酵工业, 2009, 35(3): 64-67. |
| [17] | 简文杰. 魔芋葡甘聚糖螺旋微观构象及性质研究 [D]. 福州: 福建农林大学, 2011. |
| [18] | 陈小强, 张志发, 王川丕, 等. 热处理对高温煎煮和低温酶法提制绿茶多糖的影响 [J]. 应用化学, 2011, 28(4): 454-457. |
| [19] | 韩 铨. 茶树花多糖的提取、纯化、结构鉴定及生物活性的研究 [D]. 杭州: 浙江大学, 2011. |
| [20] | Poojari R, Srivastava R. Composite alginate microspheres the next-generation egg-box carriers for biomacromolecules delivery [J]. Expert Opin Drug Deliv, 2013, 10(8): 1061-1076. |
| [21] | 郭秀君, 黄雪松. 不同工艺条件对桔皮果胶钙产量的影响 [J]. 食品科技工业, 2013, 16(34): 258-261. |
 2015, Vol. 30
2015, Vol. 30


