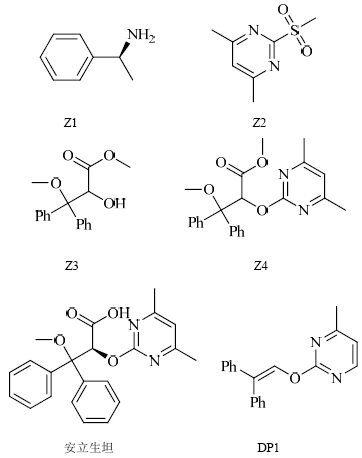
 | 图 1 安立生坦及有关物质的化学结构Fig. 1 Chemical structures of ambrisentan and its related substances |
安立生坦对照品(批号120401DZ,质量分数为99.8%)、原料药(批号120501、120502、120503)、杂质对照品Z1(批号BH-6032-100801,质量分数大于99.0%)、Z2(批号11101309,质量分数大于99.0%)、Z3(批号120113,质量分数大于99.5%)、Z4(批号120201,质量分数大于99.5%)、DP1(批号120610,质量分数大于99.0%)均由江苏康缘药业股份有限公司提供;乙腈、三氟乙酸、乙酸均为色谱纯;水为去离子水。
1.2 仪器岛津高效液相色谱仪,包括LC-20AD泵、SIL-20AC自动进样器、CTO-20AC柱温箱、SPD-M20A检测器、Labsolution工作软件;Sartorius BP221D电子天平。
2 方法与结果 2.1 色谱条件Waters Atlantis T3色谱柱(250 mm×4.6 mm,5 μm);以0.02%三氟乙酸水溶液(A)-0.01%三氟乙酸乙腈溶液(B)为流动相,进行梯度洗脱,时间/流动相A分别为0 min/75%、17 min/40%、22 min/40%、45 min/20%;柱温30 ℃;体积流量1.0 mL/min;自动进样器控温5 ℃;检测波长220 nm。
2.2 溶液的制备 2.2.1 安立生坦及杂质储备液的制备称取安立生坦、杂质Z1、Z2、Z3、Z4、DP1对照品各约12.5 mg,精密称定,置50 mL量瓶,加乙腈溶解并稀释至刻度,摇匀,即得。
2.2.2 供试品溶液的制备 取安立生坦原料药约12.5 mg,精密称定,置50 mL量瓶,加0.01%三氟乙酸乙腈溶液-0.02%三氟乙酸水溶液(25∶75)溶解并稀释至刻度,摇匀,即得原料药供试品溶液。精密量取1.0 mL,置100 mL量瓶,加溶剂稀释至刻度,摇匀,即得1%自身对照溶液。 2.3 系统适用性试验取安立生坦原料药约12.5 mg, 精密称定,置50 mL量瓶,加入杂质储备液0.5 mL,再加0.01%三氟乙酸乙腈溶液-0.02%三氟乙酸水溶液(25∶75溶解并稀释至刻度,摇匀。精密量取20 μL,连续进样6次,记录色谱图,结果各杂质峰均能完全分离,杂质峰面积的RSD值均在2.0%以下,表明系统适用性良好。
2.4 专属性试验取3份安立生坦原料药约12.5 mg,分别加0.1 mol/L盐酸溶液2 mL、1 mol/L氢氧化钠溶液2 mL,3%过氧化氢溶液2 mL,置80 ℃水浴加热6 h,取出冷却,调至中性,即得酸、碱、氧化降解样品;另取安立生坦原料药适量,分别置于80 ℃烘箱及4 500 lx光照试验箱中放置10 d,即得高温、强光照降解样品。分别取各样品,制备供试品溶液,进样分析。结果安立生坦原料药在酸性、氧化条件下不稳定,主要降解产物为杂质DP1;安立生坦原料药在碱性、高温和强光照条件下稳定,未发生显著变化。各降解条件产生的杂质均能完全分开,色谱图见图 2。
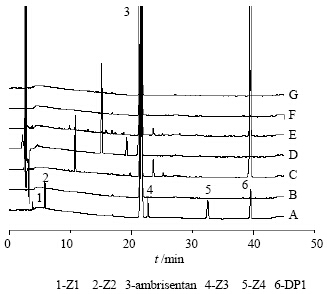 | 图 2 安立生坦加已知杂质(A)、安立生坦原料药(B)、酸降解样品(C)、碱降解样品(D)、氧化降解样品(E)、高温降解样品(F)、强光照降解样品(G)HPLC图谱Fig. 2 HPLC chromatograms of ambrisentan spiked with known impurities (A), ambrisentan active pharmaceutical ingredients (B), acid degradation sample (C), alkaline degradation sample (D), oxidative degradation sample (E), high-temperature degradation sample (F), and light degradation sample (G) |
取安立生坦及杂质储备溶液,加溶剂稀释制成约0.15、0.20、0.25、0.375、0.5 μg/mL溶液。精密量取20 μL,进样分析,记录色谱图。以峰面积为纵坐标,质量浓度为横坐标,进行线性回归,得安立生坦及其杂质的回归方程、相关系数及线性范围。逐步稀释线性试验溶液,定义信噪比S/N为3时为最低检出限,S/N为10时为定量限。结果见表 1。
| 表 1 安立生坦及已知杂质的线性关系及检测限结果 Table 1 Linearity, LOD, and LOQ of ambrisentan and its impurity |
取0.25 mg/mL安立生坦原料药(批号120501)供试品溶液,分别于0、1、2、4、6、8、12 h进样分析,结果已知杂质Z1、DP1、未知最大单杂质及杂质总和的RSD值分别为1.2%、3.7%、0.9%、1.8% (n=7),表明供试品溶液在12 h内稳定。
2.7 重复性试验取安立生坦原料药(批号120501)适量,平行制备6份供试品溶液,分别进样测定,结果已知杂质Z1、DP1、未知最大单杂质及杂质总和的RSD值分别为1.3%、1.8%、0.8%、1.4%(n=6)。
2.8 回收率试验取安立生坦原料药约12.5 mg, 精密称定,置50 mL量瓶,分别加入相当于安立生坦0.05%、0.08%、0.1%、0.12%、0.15%的杂质对照品,每个质量浓度制备2份供试品溶液,进样测定,计算回收率,结果杂质Z1、Z2、Z3、Z4、DP1的平均回收率分别为102.9%、96.0%、93.1%、104.6%、115.2%,RSD值分别为2.1%、4.6%、2.9%、2.7%、4.9%(n=10)。
2.9 样品测定取批号120501、120502、120503安立生坦原料适量,制备供试品溶液,进样测定。已知杂质以外标法计算,未知杂质以主成份1%自身对照法计算,结果见表 2,供试品溶液液相色谱图见图 3。
| 表 2 安立生坦中有关物质检测结果 Table 2 Determination of related substances in ambrisentan samples |
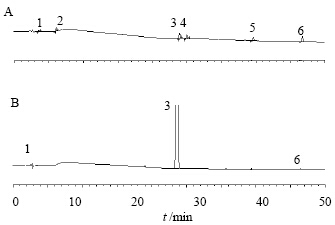 | 1-Z1 2-Z2 3-安立生坦 4-Z3 5-Z4 6-DP1 1-Z1 2-Z2 3-ambrisentan 4-Z3 5-Z4 6-DP1 图 3 有关物质对照品(A)和原料药(B)的HPLC图谱Fig. 3 HPLC chromatogram of related substances reference substances (A) and ambrisentan active pharmaceutical ingredients (B) |
安立生坦片进口药品注册标准采用乙腈-磷酸盐缓冲盐梯度洗脱,在不进样空运行梯度程序时有鬼峰出现,影响杂质的检查,可能与缓冲盐中的微量杂质在色谱柱上的蓄积有关,不易消除。文献报道[3]磷酸盐缓冲盐溶液pH值为6.5,安立生坦分子(pKa为4.0)以离子形式在反相色谱柱上进行分离,安立生坦色谱峰拖尾严重。虽然文献报道[4]的磷酸二氢钾溶液pH值调至2.5,但在不进样空运行梯度程序时仍有鬼峰出现,影响杂质的检查。文献报道[3, 4]中的色谱条件对杂质Z1均保留较弱,与溶剂峰未完全分开。本实验建立的0.02%三氟乙酸-0.01%三氟乙酸乙腈为流动相的梯度洗脱体系可以有效的 解决上述问题:(1)流动相中添加三氟乙酸,使极性大的杂质(S-1-苯乙胺)得以在色谱柱上有所保留;(2)采用梯度洗脱,使极性小的杂质(DP1)能够洗脱下来;(3)乙腈、三氟乙酸在220 nm波长处均有紫外吸收,且吸收强度不同,经预试验及三氟乙酸浓度耐用性考察,确定在有机相及水相中加入不同浓度的三氟乙酸可以部分抑制梯度洗脱过程中因流动相比例变化带来的基线波动,有利于杂质的检出)。
3.2 供试品制备溶剂的选择及温度控制本法选择初始流动相作为供试品溶液的制备溶剂,可以减小溶剂峰及溶剂效应的影响。经供试品溶液稳定性考察,本品供试品溶液在自动进样器控温5 ℃环境中12 h内稳定。但本品在酸性条件下热不稳定,供试品溶液还需临用新鲜配制。
| [1] | Vatter H, Seifert V. Ambrisentan, a non-peptide endothelin receptor antagonist [J]. Cardiovasc Drug Rev, 2006, 24(1): 63-76. |
| [2] | Frampton J E. Ambrisentan [J]. Am J Cardiovasc Drugs, 2011, 11(4): 215-226. |
| [3] | 国家食品药品监督管理局. 安立生坦片进口药品注册标准JX20090317 [S]. 2010. |
| [4] | Narayana M B, Chandrasekhar K B, Rao B M. A validated specific stability-indicating RP-HPLC assay method for ambrisentan and its related substances [J]. J Chromatogr Sci, 2014, 52(8): 818-825. |
 2015, Vol. 30
2015, Vol. 30


