近年来,结核病在全世界发病率呈上升趋势,已经对全球公众健康造成了巨大威胁。目前临床常用的抗结核病药都具有一定的副作用,其中最显著的就是对肝脏的损害[1, 2]。在所有的一线抗结核病药中,异烟肼是引起肝毒性的主要药物[3],其他已报道的抗结核药物的肝毒性大多是与异烟肼合用时发现的[4]。因此,寻找一种有效的护肝方法是患者坚持抗结核治疗、减少结核耐药和复发的关键。抗结核药物导致肝损伤,患者常表现为食欲下降、恶心欲吐、皮肤巩膜黄染等症状,症状、体征与中医学的“胁痛”、“黄疸”、“药物毒”等症状相似,病位在肝,但与脾胃相关。孙琪等[5]认为本病治疗应以 疏肝健脾、化湿泄热法治疗为主。马国玲等[6]认为本病主要存在湿邪困脾、肝气郁滞、脾胃虚弱、瘀毒内结、气阴两虚,涉及脏器主要在肝胆和脾胃,虚实夹杂。当归芍药散为《金匮要略》妇人良方,具有养肝和血、健脾祛湿等功效[7]。已有研究证实当归芍药散水煎剂可治疗脂肪肝、肝硬化腹水等[8, 9]。本实验研究当归芍药散对抗结核药物所致大鼠肝损伤模型的作用,并对其作用机制进行探讨,以期为临床治疗提供实验和理论依据。
1 材料 1.1 仪器与试剂
XHF-1高速分散器(宁波新芝生物科技股份有限公司);3K15台式高速冷冻离心机(Sigma公司);756ML型紫外-可见光光度计(上海菁华科技仪器有限公司);Bio-rad垂直电泳槽、PCR仪器;水平电泳槽。
异烟肼[货号I3377,质量分数≥99%(TLC)]、利福平[货号R3501,质量分数≥97%(HPLC)]购自Sigma公司;硫普罗宁(原料药,质量分数>99%)购自海口奇力制药;当归(生品,产地甘肃)、白芍(炒品,产地安徽)、茯苓(生品,产地安徽)、白术(炒品,产地浙江)、泽泻(生品,产地福建)、川芎(生品,产地四川)均由安徽省亳州市皖中饮片厂生产;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒购自南京建成生物工程研究所;TRIZOL购自美国Invitrogen公司,cDNA合成用逆转录酶M-MLV购自Promega公司,Taq酶和PCR用缓冲混合液购自南京生兴生物工程技术服务有限公司;GAPDH(上海康成生物工程有限公司,HRP标记抗GAPDH单抗,货号KC-5G5)、TNF-α(Cell Signaling Technology公司,兔抗TNF-α抗体,货号3707)和抗兔二抗(上海晶美生物技术有限公司,HRP标记羊抗兔IgG抗体,货号SB-200)均购自商业公司;所有引物均由南京生兴生物工程技术服务有限公司设计和合成,采用文献中已有序列[10];其他试剂均为国产分析纯。
1.2 动物
SPF级SD大鼠,雄性,体质量(200±20)g,均购于南京市江宁区青龙山动物养殖中心,生产许可证号SCXK(苏)2007-0008。实验前适应环境1周,自由饮水、进食,每日12 h照明,室温(25± 2)℃。
2 方法 2.1 提取液的制备
当归芍药散每剂87 g,含当归9 g、白芍30 g、茯苓12 g、白术12 g、泽泻15 g和川芎9 g。确定全方成人每日用药量,根据人体-大鼠体表面积换算系数[11],换算大鼠的用药量,最终确定为低、中、高剂量[8、16、32 g生药/(kg·d)]。按比例将上述各药材(当归270 g、白芍900 g、茯苓360 g、白术360 g、泽泻450 g和川芎270 g)置于煎煮容器内,加相当于药材量10倍的蒸馏水,浸泡30 min后加热煮沸,开始用强火,沸腾后改用文火,保持微沸30 min,搅拌,趁热滤过。药渣再加5倍蒸馏水同法煎煮,沸后30 min,滤过。合并两次滤液,将煎煮液混合浓缩至1 740 mL,含生药量1.5 g/mL,冷藏备用。当归芍药散给药剂量按生药量计算。
2.2 动物分组、给药和处理
SD雄性大鼠60只,随机分为6组,即对照组、模型组、硫普罗宁组(60 mg/kg)和当归芍药散水提取物低、中、高剂量(8、16、32 g/kg)组,每组均为10只。当归芍药散水提取物、硫普罗宁组分别ig给药,给药容积为10 mL/kg,对照组、模型组ig给予等量生理盐水。每天上午给药1次,连续给药8周。每天在给药前1 h,除对照组给予等量生理盐水外,其余各组ip异烟肼70 mg/kg和ig给予利福平70 mg/kg[12],给药容积为10 mL/kg。
在末次给药后1 h,用10%水合氯醛300 mg/kg ip麻醉大鼠,腹主动脉取血(取血前12 h禁食,不禁水),离心取血清,置于4 ℃保存。处死动物后,于冰台快速分取肝脏组织,液氮冷冻后置于−70 ℃条件下保存。
2.3 生化指标测定
按照试剂盒说明书测定大鼠血清中ALT、AST、SOD和MDA水平。
2.4 肝脏中SOD和MDA水平测定
肝脏组织在10倍体积的生理盐水中充分匀浆,匀浆液10 000×g,4 ℃离心15 min取上清液进行测定。
2.5 肝脏组织HE染色
大鼠肝脏摘除后迅速置Carnoy氏固定剂乙醇-氯仿-醋酸(6∶3∶1)中室温固定1 d,并保存在70%乙醇中。肝组织在梯度酒精中脱水,石蜡包埋后,制片(7 μm厚)。切片在二甲苯中脱蜡后,HE染色,脱水,中性树脂封片,光学显微镜下观察。
2.6 RT-PCR法测定肝脏中肿瘤坏死因子-α(TNF-α)mRNA表达
按照文献报道方法[13]测定肝脏中TNF-α mRNA表达,并采用Quantity One 1-D软件(Bio-Rad)对条带进行吸光度分析,计算目的基因与内参GAPDH的比值,从而得到待测基因的相对表达值。
2.7 Western Blotting法测定肝脏中TNF-α蛋白表达
按照文献报道方法[13]测定肝脏中TNF-α蛋白表达,采用分析软件(Bio-Rad Laboratories,Hercules,CA)进行灰度值分析,计算目的蛋白与GAPDH的灰度比值。
2.8 数据处理及统计
所有实验数据均用数据处理结果用`x ± s表示。采用SPSS 13.0进行单因素方差分析,LSD法进行组间统计学差异分析。
3 结果 3.1 对大鼠血清ALT、AST、SOD和MDA水平的影响
与对照组比较,模型组血清ALT、AST和MDA水平均显著升高(P<0.01、0.001),血清SOD水平显著降低(P<0.001)。与模型组比较,当归芍药散水提取物中、高剂量组和硫普罗宁组均显著降低血清ALT、AST和MDA水平(P<0.05、0.01、0.001),并且显著升高血清SOD水平(P<0.01、0.001)。而当归芍药散水提取物低剂量组对ALT、AST、SOD和MDA水平均无显著影响。结果见表 1。
| 表 1 当归芍药散水提取物对抗结核药物所致肝损伤大鼠血清ALT、AST、SOD和MDA水平的影响(`x ± s,n=8) Table 1 Effects of Danggui Shaoyao Powder water extracts on serum ALT, AST, SOD,and MDA levels in antituberculosis drug-induced liver injury rats (`x ± s, n=8) |
3.2 对大鼠肝脏SOD和MDA水平的影响
与对照组比较,模型组肝脏MDA水平显著升高(P<0.01),而肝脏SOD水平显著降低(P<0.001)。与模型组比较,当归芍药散水提取物中、高剂量组和硫普罗宁组均显著降低肝脏MDA水平(P<0.01、0.001),增强肝脏SOD水平(P<0.01、0.001)。而当归芍药散水提取物低剂量组对SOD和MDA水平均无显著影响。结果见表 2。
| 表 2 当归芍药散水提取物对抗结核药物所致肝损伤大鼠肝脏SOD和MDA水平的影响(`x ± s,n=8) Table 2 Effects of Danggui Shaoyao Powder water extracts on liver SOD and MDA levels in anti-tuberculosis drug-induced liver injury rats (`x ± s, n=8) |
与正常组比较,模型组肝脏出现肝细胞水肿(水样变性)和坏死(主要为点灶状坏死)。与模型组比较,当归芍药散水提取物中、高剂量组和硫普罗宁组肝细胞水肿和坏死均有不同程度的改善。见图 1。
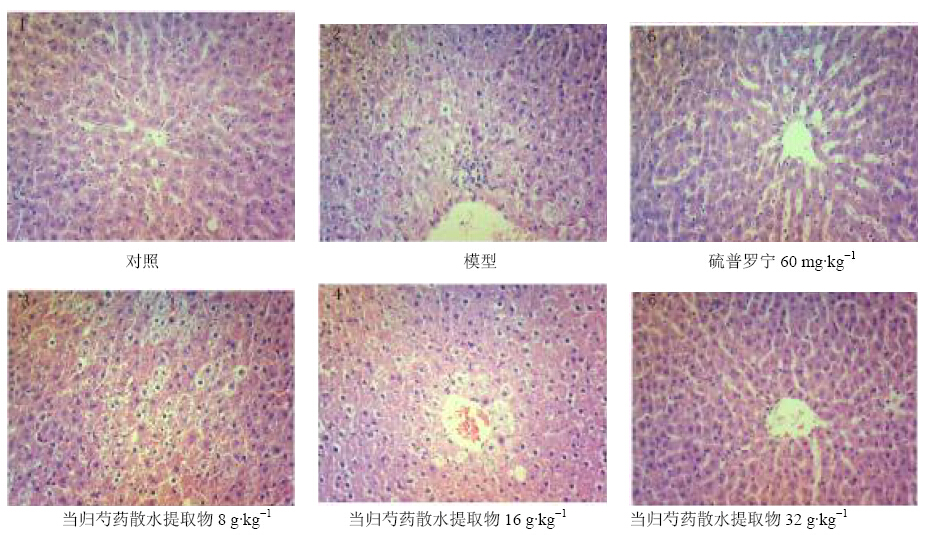 | 图 1 当归芍药散水提取物对抗结核药物所致肝损伤大鼠肝脏病理结果Fig. 1 Pathological changes of liver of Danggui Shaoyao Powder water extracts on anti-tuberculosis drug-induced liver injury rats |
与对照组比较,模型组肝脏TNF-α mRNA和蛋白表达水平均显著提高(P<0.05、0.01)。与模型组比较,当归芍药散水提取物中、高剂量组和硫普罗宁组均显著下调肝脏TNF-α mRNA和蛋白表达水平(P<0.05、0.01)。而当归芍药散水提取物低剂量组对肝脏TNF-α mRNA和蛋白表达水平均无显著影响。结果见图 2、3。
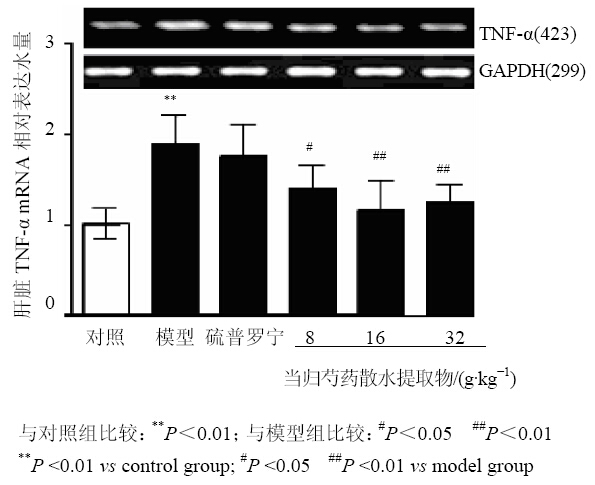 | 图 2 当归芍药散水提取物对抗结核药物所致肝损伤大鼠肝脏TNF-α mRNA表达水平的影响Fig. 2 Effects of Danggui Shaoyao Powder water extracts on liver TNF-α mRNA levels in anti-tuberculosis drug-induced liver injury rats |
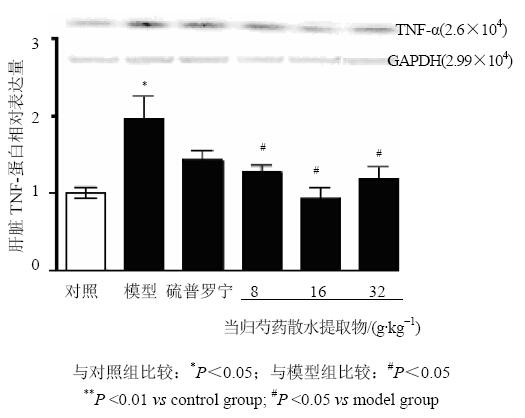 | 图 3 当归芍药散水提取物对抗结核药物所致肝损伤大鼠肝脏TNF-α蛋白表达水平的影响Fig. 3 Effects of Danggui Shaoyao Powder water extracts on liver TNF-α protein levels in anti-tuberculosis drug- induced liver injury rats |
抗结核药物所致肝损伤所表现出的症状应归属中医“肝郁血虚,肝脾失调”所致,肺结核在中医上归属“肺痨”范畴,痨病以正虚为主,在治疗肝损的过程中应以补虚为主,肝属木,脾属土,故在治疗肝损伤的同时应注意培土生金、滋水涵木,肝损伤病位在肝,涉及肺、脾、肾,中医认为人是一个整体,常以整体观治疗疾病为思路,故在治疗肝损伤过程中,应注意养血、柔肝、补肺、健脾。
当归芍药散由当归、白芍、茯苓、白术、泽泻、川芎组成,方中白芍养血敛阴、缓急止痛,为君药,白术甘苦而燥,健脾燥湿,为臣药,君臣相配,养肝扶脾,川芎条达肝气,并活血行滞,当归养血活血,茯苓渗湿健脾宁心,泽泻利湿消肿,本方的特点为肝脾同调,养血疏肝与健脾祛湿同行,养血而不腻脾胃,渗利而无伤阴血。
已有研究表明,抗结核药物所致肝损伤临床症状和体征与各型病毒性肝炎相比无特异性,易于病毒性肝炎混淆[14]。TNF-α表达失调是许多免疫介导的炎症性疾病的重要病理因素[15, 16]。在肝中,TNF-α直接或间接的诱导肝细胞死亡,在各型病毒性肝炎、非酒精性脂肪肝等引起的肝脏损伤中发挥了重要作用。因此推测,TNF-α可能介导了抗结核病药引起的大鼠肝脏损伤[17]。
当归芍药散具有抗氧化、调节免疫等药理作用。肝组织损伤与炎症、脂质过氧化等密切相关。实验研究已证实,当归芍药散可明显改善肝硬化腹水大鼠肝功能,减少腹水生成及延缓肝脏病理改变进程。且当归芍药散可治疗慢性盆腔炎,这与其降低血清TNF-α表达水平,调节机体免疫功能有关[18]。本研究显示,当归芍药散水提取物中、高剂量组血清ALT和AST水平较肝损伤组明显降低,肝细胞水肿和坏死均有不同程度的改善,且肝TNF-α mRNA和蛋白表达水平较肝损伤组也明显降低,而肝损伤组大鼠肝TNF-α mRNA和蛋白表达水平与对照组比较显著上调。研究结果说明,抗结核药物所致大鼠肝损伤的作用机制可能与肝中TNF-α异常表达有关,TNF-α在抗结核药物所致大鼠肝损伤过程中起着关键性作用,当归芍药散可能通过抑制肝中TNF-α的表达,从而改善抗结核药物所致大鼠的肝损伤。
脂质过氧化作用可引起细胞膜及线粒体膜的脂质过氧化,进而导致肝脏毒性发生,异烟肼和利福平合用引起的大鼠肝脏损伤,与脂质过氧化呈明显相关性[19]。实验研究显示,当归芍药散水提取物中、高剂量组可显著降低肝损伤大鼠血清和肝脏MDA水平,增高肝损伤大鼠血清和肝脏SOD水平,提示抑制肝脏脂质过氧化可能是当归芍药散改善抗结核药物所致大鼠肝损伤的途径之一。
本实验为深入研究抗结核药物所致大鼠肝损伤的发病机制以及当归芍药散改善肝损伤的作用机制提供了新的思路,进而为临床应用中药治疗抗结核药物所导致肝损伤提供理论依据及治疗途径。
| [1] | Huang Y S. Genetic polymorphisms of drug-metabolizing enzymes and the susceptibility to antituberculosis drug-induced liver injury [J]. Expert Opin Drug Metab Toxicol, 2007, 3(1): 1-8. |
| [2] | Pore S M, Shinde K. Risk factors for drug induced hepatitis with first-line antituberculosis drugs in hospitalized patients of pulmonary tuberculosis [J]. J Postgrad Med, 2014, 60(1): 90-92. |
| [3] | Fountain F F, Tolley E, Chrisman C R, et al. Isoniazid hepatotoxicity associated with treatment of latent tuberculosis infection: a 7-year evaluation from a public health tuberculosis clinic [J]. Chest, 2005, 128(1): 116-123. |
| [4] | Tostmann A, Boeree M J, Aarnoutse R E, et al. Antituberculosis drug-induced hepatotoxicity: concise up-to-date review [J]. J Gastroenterol Hepatol, 2008, 23(2): 192-202. |
| [5] | 孙 琪, 瞿 融. 中药治疗抗结核药所致肝损伤1例体会 [J]. 中国当代医药, 2010, 17(17): 122-122. |
| [6] | 马国玲, 崔岩飞, 韩 颖, 等. 抗结核药物导致药物性肝损害的中医证候学聚类分析 [J]. 中华中医药学刊, 2014, 32(2): 320-322. |
| [7] | 阎艳丽, 于永军, 宋晓宇, 等. 当归芍药散及煎剂对异丙肾上腺素所致大鼠心肌缺血的影响 [J]. 辽宁中医杂志, 2006, 33(9): 1203-1204. |
| [8] | 邹芷均, 孙劲晖, 田德禄. 当归芍药散治疗脂肪肝探析 [J]. 辽宁中医杂志, 2006.33(10): 1263-1264. |
| [9] | 王成业, 许 钒, 王满媛, 等. 当归芍药散对肝硬化腹水大鼠的干预作用研究 [J]. 中国中药杂志, 2013. 38(6): 871-874. |
| [10] | Hu Q H, Zhang X, Pan Y, et al. Allopurinol, quercetin and rutin ameliorate renal NLRP3 inflammasome activation and lipid accumulation in fructose-fed rats [J]. Biochem Pharmacol, 2012, 84(1): 113-125. |
| [11] | 李仪奎. 中国药理实验方法学 [M]. 上海: 上海科学技术出版社, 1991: 398. |
| [12] | 褚春薇, 陈继婷. 加味一贯煎对抗结核药所致的大鼠肝损伤的防治作用 [J]. 中国实验方剂学杂志, 2012.18(15): 201-204. |
| [13] | 吕耀中, 胡庆华, 王 星, 等. 二妙丸水提取物对高尿酸血症小鼠尿酸失衡及其相关基因和蛋白水平的影响 [J]. 中草药, 2010. 41(3): 418-423. |
| [14] | 曾丽翔, 王冬敏, 李亚发. 抗结核药所致药物性肝病分析 [J]. 河北医学, 2006. 12(1): 29-31. |
| [15] | Wong M, Ziring D, Korin Y, et al. TNF alpha blockade in human diseases: mechanisms and future directions [J]. Clin Immunol, 2008, 126(2): 121-136. |
| [16] | Tracey D, Klareskog L, Sasso E H, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review [J]. Pharmacol Ther, 2008, 117(2): 244-279. |
| [17] | Schwabe R F, Brenner D A. Brenner. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways [J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(4): G583-G589. |
| [18] | 王志国. 当归芍药散对慢性盆腔炎模型大鼠的TNF-α、IL-2影响 [J]. 中医药学报, 2005, 33(5): 35-36. |
| [19] | 查月芳, 张广宇, 李志惠, 等. 抗结核药物的肝损害与脂质过氧化反应的关系 [J]. 河北医药, 2004, 26(9): 689-691. |
 2015, Vol. 30
2015, Vol. 30


