2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
流行性感冒是流感病毒引起的急性呼吸道传染病,发病率高,流行广泛,传播迅速[1]。在世界范围内,每次流行性感冒流行造成300~500万例严重疾病患者和25~50万例患者死亡[2]。由于流感病毒有多种亚型,各亚型抗原容易发生重组和/或变异,特异性疫苗的研发相对滞后。目前获FDA许可的抗流感药物主要有两类:一类为M2离子通道阻断剂(金刚烷胺和金刚乙胺),另一类是神经氨酸酶抑制剂(扎那米韦和奥司他韦)[3]。但是金刚烷胺类药物存在神经系统毒性,仅对甲型流感病毒有效,而奥司他韦的生产成本高,因此新的抗病毒药物的研发迫在眉睫。神经氨酸酶抑制剂通过抑制流感病毒神经氨酸酶的活性阻断病毒的进一步感染和扩散,避免病毒颗粒分散而导致的免疫逃逸现象,因此神经氨酸酶抑制剂是抗流感药物研究的热点之一。芦丁(即芸香苷,结构式见图 1)是植物界分布较广的一种黄酮类化合物[4, 5, 6],临床上主要用于脆性增加的毛细血管出血症。王艳芳[7]研究表明芦丁对流感病毒感染导致的小鼠肺部病变具有保护作用,因此本研究复制了体外模型,围绕芦丁抑制流感病毒药效及其可能的作用机制进行了研究。
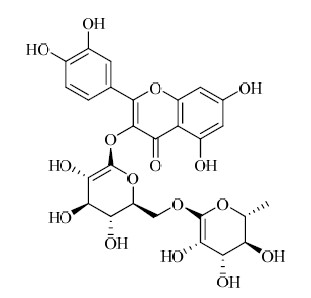 | 图 1 芦丁的结构式Fig.1 Structure of rutin |
芦丁购于中国食品药品检定研究院,质量分数为98%,规格40 mg/支,批号201409。奥司他韦羧酸盐购自上海佰世凯化学科技有限公司,批号20130207,质量分数≥95%,规格500 mg。
狗肾传代细胞(MDCK细胞株)购于美国ATCC细胞库,由江苏康缘现代中药研究院保存。RPMI-1640培养基购自南京凯基生物科技发展有限公司,批号20141023,细胞生长液中含10%胎牛血清、1×105 U/L青霉素、100 mg/L链霉素。细胞维持液中除2%胎牛血清外,其他组成同细胞生长液。
流感病毒A/PuertoRico/8/1934(H1N1)、A/FM1/1/47(H1N1)、A/Human/Hubei/3/2005(H3N2)、A/Beijing/32/92 (H3N2)由中国科学院武汉病毒研究所陈绪林研究员惠赠,由江苏康缘现代中药研究院保存。9~11 d龄鸡胚(SPF级)尿囊腔中传代培养,3 000 r/min离心5 min,经0.22 μm滤膜滤过除菌,经血凝试验测定血凝滴度大于1∶512后分装,置−80 ℃保存备用。
MTS细胞增殖定量检测试剂盒购于Promega公司,批号0000105328。2-吗啉乙磺酸(MES)购于上海沃凯化学试剂有限公司,批号20140901。MES缓冲液含32.5 mmol/L MES、4 mmol/L CaCl2,NaOH调节pH 6.5。神经氨酸酶荧光底物(4-甲基伞形酮)-N-乙酰基-α-D-神经氨酸(MUNANA)购于Sigma公司,批号SLBH6262V。
Flex Station 3多功能微孔板读数仪购自Molecular Devices公司;CKX41倒置显微镜购自Olympus公司;FormaSteri-Cycle371二氧化碳培养箱购自Thermo Scientific公司;HFsafe-1200生物安全柜购自Heal Force公司。
2 方法 2.1 MDCK细胞种板及培养MDCK细胞用含10%胎牛血清的1640培养基按5×104/mL接种到96孔板中,每孔100 μL,37 ℃、5% CO2培养箱中培养过夜形成细胞单层,约铺满96孔板底70%[2, 8, 9]。
2.2 芦丁对MDCK细胞的毒性作用MDCK细胞种板培养24 h后,弃去上清,PBS清洗1次后给药。芦丁用细胞维持液稀释至100、200、400、500、1 000、1 500 μmol/L,按100 μL/孔给药。同时设置正常细胞对照组(给予100 μL细胞维持液),每组设置3个复孔。细胞置于37 ℃、5% CO2培养箱中培养。培养48 h后,弃去孔内上清液,避光加入含10% MTS的无血清1640培养基(100 μL/孔),孵育2 h后测定A490,取3个孔的均值,确定芦丁的最大无毒浓度[10]。实验重复3次,计算芦丁对MDCK细胞的半数毒性浓度(CC50)。
2.3 芦丁对流感病毒的体外抑制作用MDCK细胞种板培养24 h后,弃上清,PBS清洗,加入无血清1640培养基稀释的流感病毒A/PuertoRico/8/1934(H1N1)感染细胞(100 TCID50),每孔100 μL,35 ℃孵育2 h后,弃去病毒液[11, 12]。分别按100 μL/孔加入含芦丁20、50、100、200、300 μmol/L细胞维持液,同时设对照组、模型组及2 μmol/L奥司他韦羧酸盐组,每组设置3个复孔。细胞于37 ℃、5% CO2培养箱中培养48 h,观察细胞病变现象,并于倒置显微镜下拍照记录。48 h后弃上清,避光加入含10% MTS的无血清1640培养基,每孔100 μL,孵育2 h后测定A490,取3个孔的平均值。实验共重复3次。计算芦丁对病毒的抑制率、半数有效浓度(EC50)和选择指数(SI)。
抑制率=(A490给药-A490模型)/( A490正常-A490模型)
SI=CC50/EC50
为考察芦丁抗流感病毒的广谱性,另外分别以A/FM1/1/47(H1N1)株、A/Beijing/32/92(H3N2)株和A/Human/Hubei/3/2005(H3N2)株建模,考察芦丁抗流感病毒作用的体外药效,方法同上。
2.4 芦丁对不同剂量流感病毒的体外抑制作用MDCK细胞种板培养24 h后,弃上清,PBS清洗,采用无血清1640培养基将病毒稀释至0.1、0.2、0.5 MOI,分别感染细胞(100 μL/孔),35 ℃孵育2 h后,弃去病毒液。分别加入含100、300 μmol/L芦丁的细胞维持液,同时设置对照组和不同病毒感染剂量的模型组,每组设置3个复孔。细胞于37 ℃、5% CO2培养箱中培养48 h后,观察细胞病变现象[13, 14]。48 h后检测细胞增殖情况,计算抑制率。
2.5 芦丁加药方式对流感病毒的体外抑制作用 2.5.1 病毒感染前给药MDCK细胞种板后,培养12 h后,弃上清,按100 μL/孔加入含芦丁20、50、100、200、300 μmol/L细胞维持液,37 ℃继续培养12 h后弃上清,PBS清洗后,加入无血清1640培养基稀释的流感病毒感染细胞(100 TCID50),100 μL/孔,35 ℃孵育2 h,弃病毒液上清,换细胞维持液[2]。
2.5.2 病毒感染同时给药MDCK细胞种板后,培养24 h后,弃上清及PBS清洗后,加入含芦丁和流感病毒的无血清1640培养基各50 μL,芦丁终浓度为20、50、100、200、300 μmol/L,流感病毒造模剂量为100 TCID50,35 ℃孵育2 h后弃病毒液上清,换细胞维持液[15]。
2.5.3 病毒感染后给药MDCK细胞种板后,培养24 h后,弃上清,PBS清洗,加入无血清1640培养基稀释的流感病毒(100 TCID50),100 μL/孔,35 ℃孵育2 h后,弃去病毒液[11, 12],分别按100 μL/孔加入含芦丁20、50、100、200、300 μmol/L细胞维持液[16]。
实验同时设对照组和模型组。以上各组细胞于37 ℃、5% CO2培养箱中培养48 h,观察细胞病变现象。48 h后检测细胞增殖情况,计算抑制率。
2.6 芦丁对流感病毒神经氨酸酶的抑制作用病毒的神经氨酸酶可以特异性地分解荧光底物MUNANA,产生的荧光强度与神经氨酸酶的活性呈正相关[3, 17]。实验在96孔黑板中进行,除背景组外各孔分别加入30 μL MES缓冲液10倍稀释的A/PuertoRico/8/1934(H1N1)病毒尿囊液,再加入10 μL含芦丁20、50、100、200、300 μmol/L MES缓冲液,37 ℃孵育5 min后避光加入MUNANA(0.1 mmol/L,溶于MES缓冲液)20 μL。实验同时设置对照组(不加芦丁)和背景组(不加芦丁和尿囊液),反应体系用MES缓冲液统一加至100 μL。37 ℃孵育20 min后,按100 μL/孔加入终止液(含14 mmol/L NaOH和83%乙醇),于Ex=360 nm、Em=440 nm处测定荧光强度(F)值[18, 19],计算芦丁对于神经氨酸酶的抑制率,IC50定义为神经氨酸酶酶活下降50%时芦丁的浓度。
抑制率=(F对照-F加药)/(F对照-F背景)
为考察芦丁对不同流感病毒毒株神经氨酸酶活性的抑制作用,分别以A/FM1/1/47(H1N1)、A/Beijing/32/92(H3N2)、A/Human/Hubei/3/2005(H3N2)株的尿囊液建模,方法同上。
2.7 统计方法采用SPSS 18.0 for Windows统计分析软件进行统计学分析,各组间差异比较用方差分析。
3 结果 3.1 芦丁对MDCK细胞的毒性作用0~300 μmol/L芦丁对MDCK细胞的正常生长没有影响,细胞形态在镜下未见明显改变。MTS法测定表明当芦丁浓度小于300 μmol/L时,A490 nm也未出现明显的下降,MDCK细胞存活率大于95%;当芦丁浓度大于300 μmol/L时,细胞活力逐步下降,呈明显的浓度相关性。见图 2。因此芦丁在0~300 μmol/L对MDCK细胞没有细胞毒性,可用于考察其体外抗病毒药效。根据上述结果可得芦丁对MDCK细胞的CC50为1 075.0 μmol/L。
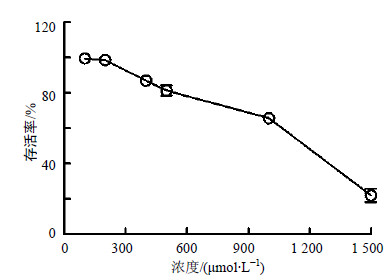 | 图 2 芦丁对MDCK细胞的细胞毒性Fig.2 Cellular toxicity of rutin on MDCK cells |
流感病毒感染MDCK细胞后,导致细胞发生明显的病变,致使细胞活力显著下降。芦丁对流感病毒A/PuertoRico/8/1934(H1N1)具有明显的体外抑制作用,镜下可见芦丁逐步减轻病毒导致的MDCK细胞病变(图 3);随着芦丁剂量的增加,对流感病毒A/PuertoRico/8/1934(H1N1)的抑制作用逐渐增强,其中300 μmol/L芦丁对流感病毒A/PuertoRico/8/1934(H1N1)的抑制作用显著优于奥司他韦(P<0.05),见表 1。
 | 图 3 芦丁对流感病毒A/PuertoRico/8/1934(H1N1)感染引起细胞病变的影响Fig.3 Effect of rutin against virus infection caused by influenza virus A/PuertoRico/8/1934(H1N1) |
| 表 1 芦丁对流感病毒A/PuertoRico/8/1934(H1N1)的体外抑制作用 Table 1 Inhibitory effects in vitro of rutin against influenza virus A/PuertoRico/8/1934(H1N1) |
随着流感病毒A/PuertoRico/8/1934(H1N1)感染细胞的剂量增加,MDCK细胞活力逐步下降,细胞病变程度加剧,芦丁对流感病毒的抑制作用随着病毒感染剂量的增加而逐渐减弱,见表 2。
| 表 2 芦丁对不同剂量流感病毒A/PuertoRico/8/1934(H1N1) 感染的体外抑制作用 Table 2 Inhibitory effects of rutin against influenza virus A/PuertoRico/8/1934(H1N1) with different MOI |
芦丁对4株病毒A/PuertoRico/8/1934(H1N1)、A/FM1/1/47(H1N1)、A/Human/Hubei/3/2005(H3N2)、A/Beijing/32/92 (H3N2)的EC50和SI见表 3。结果表明芦丁对4株流感病毒均具有体外抑制作用,其中对A/PuertoRico/8/1934(H1N1)株的EC50最小,SI最大,提示芦丁对该毒株体外药效最好。
| 表 3 芦丁对不同流感病毒体外药效 Table 3 Antiviral activity of rutin against different strains of influenza virus in vitro |
进一步通过病毒感染前、感染同时和感染后给药研究芦丁对流感病毒A/PuertoRico/8/1934(H1N1)生命周期不同阶段的抑制效应,见表 4。50~300 μmol/L芦丁于感染前给药对宿主细胞表面结构没有影响,感染同时给药对流感病毒入侵宿主细胞无明显阻断作用,然而于感染后给药对病毒的药效显著优于其他两种给药方式(P<0.01),并呈剂量相关性。提示芦丁在流感病毒感染后给药的效果最为明显,主要抑制流感病毒感染后的阶段,包括子代病毒颗粒的释放和扩散等,从而阻断流感病毒的进一步感染。
| 表 4 芦丁对流感病毒生命周期不同阶段的抑制作用 Table 4 Inhibitory effects of rutin on different stage of influenza virus infection |
芦丁对流感病毒A/PuertoRico/8/1934(H1N1)的神经氨酸酶活性的抑制作用具有剂量相关性,见表 5。随着芦丁浓度升高,荧光强度减弱,表明神经氨酸酶活性逐步被抑制。
| 表 5 芦丁对流感病毒A/PuertoRico/8/1934(H1N1)神经氨酸酶的抑制作用 Table 5 Inhibition of rutin on neuraminidase of influenza A/PuertoRico/8/1934(H1N1) virus |
芦丁对4株流感病毒神经氨酸酶的IC50见表 6。结果表明芦丁对4株流感病毒活性均具有体外抑制作用,其中对流感病毒A/FM1/1/47(H1N1)的IC50最小,提示芦丁对该毒株神经氨酸酶活性抑制作用相对最好。
| 表 6 芦丁抑制流感病毒神经氨酸酶的IC50 Table 6 IC50 values of rutin against neuraminidase of different strains |
与化学药相比,中药和天然药物具有更广泛的适应性和优越性。当病毒发生变异、对化学药产生耐药性的情况下,中药和天然药物仍具有潜在治疗作用。中草药在我国资源丰富,价格低廉,为新药研制提供了物质和结构基础,具备广阔的研究与开发前景。
本研究探讨了芦丁对流感病毒的体外抑制活性,结果表明,芦丁对A/PuertoRico/8/1934(H1N1)具有显著的体外抑制作用,且呈现良好的剂量相关性,同时,芦丁对流感病毒A/FM1/1/47(H1N1)、A/Beijing/32/92(H3N2)、A/Human/Hubei/3/2005(H3N2)毒株也表现出较好的体外抑制作用,表明其抗流感病毒活性具有一定的广谱性。研究结果表明,芦丁仅在流感病毒感染后给药后表现出抗流感病毒活性,说明芦丁可能作用于流感病毒的释放和扩散阶段。在此阶段,神经氨酸酶主要通过水解唾液酸残基,切断病毒颗粒与宿主细胞间的联系,使新生流感病毒颗粒从宿主细胞释放,造成进一步感染。进一步的研究发现,芦丁对流感病毒神经氨酸酶具有显著的抑制作用,解释了芦丁仅在流感病毒感染后加药有效的现象,提示其抗流感病毒的作用机制可能与对神经氨酶的抑制作用有关。有趣的是,芦丁在酶水平上的抑制浓度及作用趋势与其在细胞水平上对流感病毒的抑制浓度及作用趋势接近,进一步表明神经氨酸酶可能是芦丁抑制流感病毒的作用靶点之一。
综上所述,本研究证实了芦丁体外具有直接抑制流感病毒的作用,阐述了抑制流感病毒神经氨酸酶是芦丁抗流感病毒活性的主要机制之一,为进一步探索芦丁应用于抗流感药物开发和治疗奠定了基础。本研究仍存在一些需要深入研究的部分,如本实验明确了芦丁对流感病毒神经氨酸酶的抑制作用,但是对于芦丁与神经氨酸酶的结合方式尚需进一步的探索,这将有助于研究芦丁的广谱性以及预测其对耐药病毒株的敏感性。
| [1] | Watanabe K, Rahmasari R, Matsunaga A, et al. Anti-influenza viral effects of honey in vitro: potent high activity of manuka honey [J]. Arch Med Res, 2014, 45(5): 359-365. |
| [2] | Ding Y, Dou J, Teng Z, et al. Antiviral activity of baicalin against influenza A (H1N1/H3N2) virus in cell culture and in mice and its inhibition of neuraminidase [J]. Arch Virol, 2014, 159(12): 3269-3278. |
| [3] | Müller P, Downard K M. Catechin inhibition of influenza neuraminidase and its molecular basis with mass spectrometry [J]. J Pharm Biomed Anal, 2015, 111: 222-230. |
| [4] | 金 越, 吕 勇, 韩国柱 等. 槲皮素及异槲皮素、芦丁抗自由基活性的比较研究 [J]. 中草药, 2007, 38(3): 408-412. |
| [5] | 周 鹏, 吴建章, 仇佩虹 等. 芦丁-硒配合物的合成及抗肿瘤活性研究 [J]. 中国药学杂志, 2007, 42(24): 1905-1907. |
| [6] | 周新妹, 姚 慧, 夏满莉 等. 槲皮素与芦丁对离体大鼠主动脉环的舒张作用及机制 [J]. 浙江大学学报: 医学版, 2006, 35(1): 29-33. |
| [7] | 王艳芳, 王新华, 朱宇同 等. 芦丁对甲型流感病毒抑制作用实验研究 [J]. 中医药学刊, 2005, 23(5): 827. |
| [8] | Cai W, Li Y, Chen S, et al. 14-Deoxy-11,12-dehydroandrographolide exerts anti-influenza A virus activity and inhibits replication of H5N1 virus by restraining nuclear export of viral ribonucleoprotein complexes [J]. Antiviral Res, 2015, 118: 82-92. |
| [9] | Droebner K, Pleschka S, Ludwig S, et al. Antiviral activity of the MEK-inhibitor U0126 against pandemic H1N1v and highly pathogenic avian influenza virus in vitro and in vivo [J]. Antiviral Res, 2011, 92(2): 195-203. |
| [10] | 李长山, 王聚乐, 普 珍 等. 藏药多刺绿绒蒿提取物体外抗流感病毒作用的初步研究 [J]. 中药药理与临床, 2012(5): 130-132. |
| [11] | Kai H, Obuchi M, Yoshida H, et al. In vitro and in vivo anti-influenza virus activities of flavonoids and related compounds as components of Brazilian propolis (AF-08) [J]. J Funct Foods, 2014, 8: 214-223. |
| [12] | 郭姗姗, 高英杰, 马雪萍 等. 一叶抗流感胶囊抑制甲型H1N1流感病毒感染的体内外研究 [J]. 中国实验方剂学杂志, 2014, 20(18): 123-127. |
| [13] | 刘 蓉, 何 婷, 曾 南, 等. 桂枝挥发油及桂皮醛抗流感病毒的机制研究 [J]. 中草药, 2013, 44(11): 1460-1464. |
| [14] | 徐军烈, 蒋维尔. 石香薷水提物抗流感病毒作用研究 [J]. 浙江中医杂志, 2013, 48(4): 273-274. |
| [15] | Hsieh C F, Lo C W, Liu C H, et al. Mechanism by which ma-xing-shi-gan-tang inhibits the entry of influenza virus [J]. J Ethnopharmacol, 2012, 143(1): 57-67. |
| [16] | Saha R K, Takahashi T, Kurebayashi Y, et al. Antiviral effect of strictinin on influenza virus replication [J]. Antiviral Res, 2010, 88(1): 10-18. |
| [17] | Couzens L, Gao J, Westgeest K, et al. An optimized enzyme-linked lectin assay to measure influenza A virus neuraminidase inhibition antibody titers in human sera [J]. J Virol Methods, 2014, 210C: 7-14. |
| [18] | Wang D, Sleeman K, Huang W, et al. Neuraminidase inhibitor susceptibility testing of influenza type B viruses in China during 2010 and 2011 identifies viruses with reduced susceptibility to oseltamivir and zanamivir [J]. Antiviral Res, 2013, 97(3): 240-244. |
| [19] | Tian L, Wang Z, Wu H, et al. Evaluation of the anti-neuraminidase activity of the traditional Chinese medicines and determination of the anti-influenza A virus effects of the neuraminidase inhibitory TCMs in vitro and in vivo [J]. J Ethnopharmacol, 2011, 137(1): 534-542. |
| [20] | Takashita E, Meijer A, Lackenby A, et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors, 2013-2014 [J]. Antiviral Res, 2015, 117: 27-38. |
 2015, Vol. 30
2015, Vol. 30


