2. 石药集团中奇制药技术(石家庄)有限公司, 河北 石家庄 050000;
3. 华药集团爱诺有限公司, 河北 石家庄 050000;
4. 石药集团恩必普药业有限公司, 河北 石家庄 050000
2. Shijiazhuang Pharma Group Zhongqi Pharmaceutical technology(Shijiazhuang)Co., Ltd., Shijiazhuang 050000, China;
3. North China Pharmaceutical Group Aino Co., Ltd., Shijiazhuang 050000, China;
4. Shijiazhuang Pharma Group NBP Pharmaceutical Co., Ltd., Shijiazhuang 050000, China
头孢孟多酯钠是一种注射用广谱头孢菌素,由美国礼来公司开发成功,于1977年首先在南非上市,于1978年在美国上市,商品名Mando,被认为是一种高效安全的头孢菌素。有关物质研究作为药学研究的重中之重,也是国家药品审评过程中较为关注的一项重要技术指标[1, 2, 3, 4]。抗生素因制备工艺、化学结构及组分等方面的特殊性决定了其杂质引入途径、杂质谱构成等较一般小分子化学合成药更为复杂[5]。因此,建立良好、有效的有关物质检测方法在抗生素药物研发中非常必要。注射用头孢孟多酯钠中有关物质研究在《中国药典》2010年版二部中只规定了单杂和总杂质的限度分别为1.0%、3.0%[6];在《英国药典》中纳入了4个已知杂质[7],分别为5-巯基-1-甲基四氮唑(杂质D)、(R)-O-甲酰扁桃酰基-7-去乙酰氧基头孢烯酸(杂质A)、(R)- O-乙酰头孢孟多酯(杂质C)、(R)-O-甲酰扁桃酰基-7-乙酰氧头孢烯酸(杂质E)。本实验参照现有标准[6, 7]建立了头孢孟多酯钠中有关物质的检测方法,并对《英国药典》中纳入的4个已知杂质(结构式见图 1)进行了分析,通过对不同厂家产品中杂质情况对比,制定了杂质的限度。结果证明所制定方法合理有效,重复性好,准确度高。
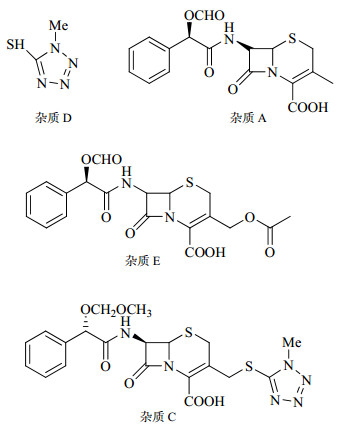 | 图 1 有关物质的化学结构Fig.1 Chemical structures of related substances |
Waters 高效液相色谱仪;XA205型电子分析天平。
注射用头孢孟多酯钠分别为批号110312,规格2.0 g,自制;批号20131201,规格1.0 g,南京海辰药业股份有限公司;批号K1308102,规格2.0 g,华北制药河北华民制药有限责任公司;批号130222,规格1.0 g,政德制药股份有限公司。头孢孟多酯钠原料(批号20004LJ86H-C)由齐鲁安替制药有限公司提供。杂质A(质量分数96.5%)、杂质C(质量分数94.5%)、杂质E(质量分数85.9%)对照品均为自制;杂质D对照品(质量分数98.5%)由北京百灵威科技有限公司提供;头孢孟多酯(质量分数88.2%)由中国食品药品检定研究院提供。
2 方法与结果 2.1 色谱条件菲罗门Luna C18(2)色谱柱(250 mm×4.6 mm,5 μm),流动相为1%三乙胺溶液(用磷酸调节pH值至2.5)-乙腈(76∶24),体积流量为1.5 mL/min,检测波长为254 nm,柱温为40 ℃,进样量为20 μL。
2.2 专属性试验样品约25 mg置50 mL量瓶中,加流动相溶解并稀释至刻度,置80 ℃水浴中1 h,即得高温破坏溶液。样品约25 mg置50 mL量瓶中,加双氧水2滴,放置10 min后,加流动相溶解并稀释至刻度,即得H2O2破坏溶液。样品约25 mg置50 mL量瓶中,加0.1 mol/L HCl溶液5 mL,放置10 min,加0.1 mol/L NaOH溶液5 mL中和,加流动相溶解并稀释至刻度,即得HCl破坏溶液。样品约25 mg,置50 mL量瓶中,加0.1 mol/L NaOH溶液5 mL,放置10 min,加0.1 mol/L HCl溶液5 mL中和,加流动相溶解并稀释至刻度,即得NaOH破坏溶液。取各溶液进样测定,结果见图 2。从破坏试验的结果可知,在制定的色谱条件下,新产生的杂质均能有效分离,对特定杂质的检测不会产生影响。
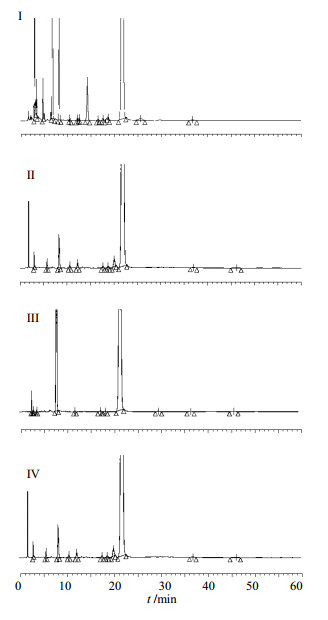 | 图 2 高温破坏(I)、H2O2破坏(II)、HCl破坏(III)和NaOH破坏(IV)所得HPLC图谱Fig.2 HPLC chromatograms of destroyed by high temperature (I), H2O2 solution (II), HCl solution (III), and NaOH solution (IV) |
取杂质D、A、E对照品和样品,配制成含杂质D对照品1.0%,杂质A、E分别为0.5%的供试品溶液,对杂质A和杂质E进行定位,考察限度量下的分离度符合规定。见图 3。
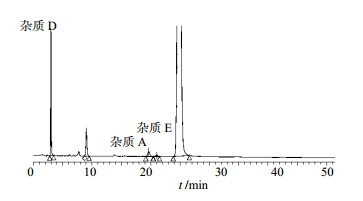 | 图 3 特定杂质定位的HPLC图谱Fig.3 HPLC chromatogram of localization of specific impurities |
取杂质D对照品10 mg,精密称定,置100 mL量瓶中,加流动相溶解并稀释至刻度,摇匀。精密量取5 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,即得。
2.4.2 供试品溶液的制备取本品25 mg置50 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,滤过,作为供试品溶液。
2.4.3 线性关系考察取杂质D对照品约10 mg,精密称定,置100 mL量瓶中,加流动相溶解并稀释至刻度,摇匀。取上述溶液1、2、4、5、6、10 mL,分别置100 mL量瓶中,加流动相至刻度。精密取20 μL,注入色谱仪,记录色谱图。以进样质量为横坐标,峰面积为纵坐标,绘制标准曲线,得线性方程Y=41 812 X+236.73,r=0.999 9,结果表明杂质D在0.02~0.20 μg与峰面积线性关系良好。
2.4.4 定量限测定取“线性关系考察”中最小质量浓度溶液5 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀。精密量取20 μL,注入色谱仪,记录色谱图。当质量浓度为0.05 μg/mL时,计算信噪比S/N≈10。连续进样6次,计算进样精密度RSD值≤5.0%。计算定量限为0.01%。
2.4.5 精密度试验取杂质D对照品适量,加流动相溶解并稀释成0.01 mg/mL的溶液。精密量取20 μL,注入色谱仪,连续进样6次,记录色谱图,计算得其峰面积的RSD值为0.52%。
2.4.6 稳定性试验取0.01 mg/mL杂质D对照品溶液,精密量取20 μL,分别在0、2、4、8 h注入色谱仪,记录色谱图,计算得其峰面积的RSD值为1.31%,表明溶液在8 h之内稳定。
2.4.7 回收率试验取杂质D对照品约10 mg,精密称定,置100 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,作为对照品贮备液。另取自制样品9份,各约50 mg,精密称定,分置100 mL量瓶中,再各加入对照品贮备液4、5、6 mL,各3份,加流动相溶解并稀释至刻度,摇匀。精密量取20 μL,注入色谱仪,记录色谱图,计算得平均回收率为101.80%,RSD值为0.87%。
2.4.8 测定方法杂质D为主要降解产物,采用杂质对照品法外标法进行定量计算,结果见表 1。杂质D峰与主成分峰的相对保留时间约为0.14。结果见表 1。
| 表 1 不同厂家注射用头孢孟多酯钠中有关物质的检测结果 Table 1 Results of related substances in Cefamandole Nafate for injection from different manufacturer |
取杂质A、E、C对照品及头孢孟多酯对照品各约10 mg,精密称定,置100 mL量瓶中,加流动相溶解并稀释至刻度,制成各约含0.1 mg/mL的溶液。精密量取上述溶液1、2、3、4、5、6 mL,分别置100 mL量瓶中,加流动相稀释至刻度。精密量取上述溶液20 μL,注入色谱仪,记录色谱图。以质量浓度为自变量,峰面积为因变量,进行线性回归,各成分的线性方程及相关系数见表 2。根据线性方程斜率,计算得杂质A、E、C的校正因子分别为1.14、1.25、1.14。
| 表 2 线性方程和相关系数 Table 2 Linear equation and correlation coefficient |
取线性试验下最小浓度溶液,逐级稀释,当杂质A质量浓度为0.02 μg/mL时,信噪比S/N≈3,计算杂质A检测限为0.004%;当杂质E质量浓度为0.1 μg/mL时,信噪比S/N≈3,计算杂质E检测限为0.02%;当杂质C质量浓度为0.2 μg/mL时,信噪比S/N≈3,计算杂质C检测限为0.04%。
2.5.3 测定方法杂质A、E、C与主成分峰的相对保留时间分别为0.81、0.84、1.38。采用加校正因子的主成分自身对照法计算,结果见表 1。
2.6 不同厂家样品有关物质的比较根据实测结果判断,杂质D为主要杂质。华北制药河北华民制药有限责任公司产品杂质A为主要杂质,考虑其原因应为生产工艺不同而产生的结果。杂质E和C的含量均较低。
3 讨论通过对杂质的来源分析及破坏试验的结果,确定杂质D为主要降解杂质,在《中国药典》中规定注射用头孢孟多酯钠中有关物质按自身对照法计算单杂和总杂的量,不能直观、准确的了解杂质D的变化情况。本实验采用对照品的外标法计算杂质D的量,将其作为特定杂质订入了质量标准,限度为不得过1.0%。对不同厂家样品中有关物质检测结果可见,样品中均含有杂质A、E、C,也将其作为特定杂质订入质量标准。杂质A、E、C对照品不易获得,实验对其校正因子进行了测定,分别为1.14、1.25、1.14,采用加校正因子的主成分自身对照法计算其含量,限度定为不超过0.5%。用此种方法进行有关物质的控制比《中国药典》二部中的规定更为科学、严谨,能更好地控制产品的质量。较《英国药典》中的自身对照法,杂质A、E、C的控制更为严格。杂质D作为头孢类抗生素药品中的主要降解产物,用外标法计算其含量,更为准确、科学。
| [1] | 中国药典[S]. 二部. 2010:附录204-206. |
| [2] | 谢沐风, 罗霞萍, 陈亚美. 如何建立HPLC法测定有关物质的方法[J]. 中国药品标准, 2002, 3(6):326-328. |
| [3] | 张玉琥. 仿制药有关物质研究的特点及研究思路[J]. 中国执业药师, 2009, 6(8):31-34. |
| [4] | 余振喜, 庾莉菊, 黄海伟, 等. 浅谈HPLC法测定有关物质时已知杂质的计算方法[J]. 中国药品标准, 2010, 11(4):278-282. |
| [5] | 张哲峰, 杂质谱分析是抗生素杂质控制的关键环节[N]. 中国医药报, 2015-05-12(A06). |
| [6] | 中国药典[S]. 第一增补本. 2010:341-342. |
| [7] | 英国药典[S]. 2013:1402. |
 2015, Vol. 30
2015, Vol. 30


