API3200型三重四极杆串联质谱仪:美国Applied Biosystems公司产品,配有电喷雾离子化源(ESI)以及Analyst 1.4.2 数据处理软件;Prominence 20A液相色谱仪:日本Shimadzu公司产品,包括CBM-20A系统控制器,LC-20AD型二元泵,DGU-20A3型脱气机,SIL-20A型自动进样器,CTO-20A型柱温箱;SORVALL LEGEND MICRO 17台式高速离心机,美国Thermo Fisher Scientific Inc.;Sigma 3-18K台式高速离心机,德国Sartorius Stedim Biotech GmbH。
1.2 药品与试剂头孢地尼颗粒(受试制剂,规格50 mg/袋,石家庄市华新药业有限责任公司,批号311130108);头孢地尼颗粒(参比制剂,商品名:全泽复,规格50 mg/袋,日本藤泽药品工业公司,批号025310)。头孢地尼对照品(质量分数95.6%,中国食品药品检定研究院提供,批号130502-201002);头孢克洛对照品(内标,质量分数93.2%,中国食品药品检定研究院提供,批号130481-200503)。甲醇为色谱纯,美国Thermo Fisher Scientific Inc.,批号127848;水为超纯水,由去离子水经KLZ-UV纯水仪纯化制得;甲酸为色谱纯,美国Dima Technology Inc.,批号14111;其他试剂均为分析纯。空白人血浆来自健康志愿者,由航天中心医院临床药理室提供。
2 方法与结果 2.1 色谱条件美国Phenomenex Inc. Security Guard Cartidges C18保护柱(4.0 mm×2.0 mm,5 μm);日本GL Sciences Inertsil ODS-SP色谱柱(75 mm×2.1 mm,3 μm);流动相:甲醇-0.5%甲酸水溶液(30∶70);体积流量:0.3 mL/min;柱温:35 ℃;进样量:10 μL。
2.2 质谱条件离子源:电喷雾离子源;离子喷射电压:5.5 kV;温度:500 ℃;源内气体1(N2)压力:310 kPa;气体2(N2)压力:310 kPa;气帘气体(N2)压力:138 kPa;正离子方式检测;扫描方式为多重反应监测(MRM);用于定量分析的离子反应分别为m/z 396.0 → m/z 227.1(头孢地尼)和m/z 367.9 →m/z 106.2(头孢克洛),解簇电压(DP)分别为36、32 V,碰撞能量(CE)分别为19、37 eV;碰撞气(N2)压力:34.5 kPa;Q1、Q3分辨率均为UNIT。
2.3 溶液和血浆样本的配制 2.3.1 头孢地尼储备液的配制精确称取头孢地尼对照品适量,用10 mmol/L乙酸铵溶液溶解并稀释,即得0.200 mg/mL头孢地尼储备液。
2.3.2 对照品血浆的配制分别取头孢地尼储备液适量,用空白血浆稀释,配制成含头孢地尼10.0、30.0、100、300、1 000、1 500、2 000 ng/mL的对照品血浆。
2.3.3 质控样本的配制分别取储备液适量,用空白血浆稀释,配制成含头孢地尼25.0、300、1 600 ng/mL质控样本。
2.3.4 质控溶液的配制分别取储备液适量,用10 mmol/L甲酸铵溶液(pH 3.0)稀释,配制成含头孢地尼0.250、3.00、16.0 μg/mL的质控溶液。
2.3.5 头孢克洛内标溶液的配制精确称取头孢克洛对照品适量,用10 mmol/L乙酸铵溶液(pH 4.25)溶解并稀释,配制成1.00 mg/mL头孢克洛溶液。精确量取该溶液适量,用10 mmol/L甲酸铵溶液(pH 3.0)稀释,即得10.0 μg/mL头孢克洛内标溶液。
2.4 血浆样本的处理取血浆样本100 μL,依次加头孢克洛内标溶液10 μL、10 mmol/L甲酸铵溶液(pH 3.0)200 μL,涡流1 min,加入10%三氯乙酸溶液80 μL,涡流1 min,12 000×g离心10 min。取样液150 μL置进样瓶中,进行LC-MS/MS分析。
2.5 分析方法确证 2.5.1 专属性试验在空白样本中加入头孢地尼对照品溶液后进行处理;在空白样本中加入头孢克洛溶液后进行处理;取空白血浆进行处理;取LLOQ质量浓度的样本进行处理;取1名受试者用药后采集的血浆样本进行处理。取以上样品测定,得色谱图,见图 1。可见头孢地尼和内标头孢克洛的保留时间分别约为1.97、2.10 min。空白血浆中的内源性物质均不干扰头孢地尼和内标头孢克洛的测定。
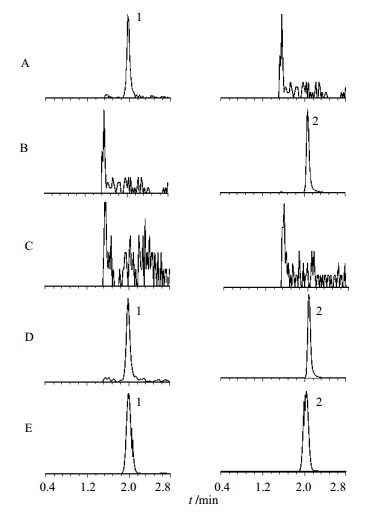 | A-0.250 μg/mL头孢地尼 B-10.0 μg/mL头孢克洛 C-空白血浆D-10.0 ng/mL LLOQ样本加入10.0 μg/mL内标 E-血浆样本加入10.0 μg/mL内标 1-头孢地尼 2-头孢克洛 A-0.250 μg/mL cefdinir B-10.0 μg/mL cefaclor C-blank serum D-10.0 ng/mL LLOQ sample added 10.0 μg/mL internal standard E-sample added 10.0 μg/mL internal standard 1-cefdinir 2-cefaclor 图 1 头孢地尼和内标头孢克洛的典型MRM色谱图Fig.1 Representative MRM chromatograms of cefdinir and internal standard cefaclor |
分别取10.0、30.0、100、300、1 000、1 500、2 000 ng/mL头孢地尼对照品血浆100 μL,依次加内标溶液10 μL、10 mmol/L甲酸铵溶液(pH 3.0)200 μL,涡流1 min,加入10%三氯乙酸溶液80 μL,涡流1 min,12 000×g离心10 min。取样液150 μL置进样瓶中进行LC-MS/MS分析。以血浆中分析物的理论质量浓度为横坐标,分析物与内标峰面积的比值为纵坐标,用加权(W=1/X2)最小二乘法进行回归运算,求得的直线回归方程,即为标准曲线。每个分析批次建立一条标准曲线,每个质量浓度2个样本,连续测定3个分析批次,结果标准曲线各质量浓度点的测定质量浓度与理论质量浓度之间的相对误差(RE)均不超过±15%,直线回归方程的相关系数(r)均大于0.99。典型回归方程为Y=1.42×10-3 X−3.87×10-3,r=0.999 7。结果表明,血浆中头孢地尼的线性范围为10.0~2 000 ng/mL。
2.5.3 LLOQ测定按“血浆样本的处理”项操作,处理LLOQ样本,每批选择6个样本,连续测定3批,以同一批的使用标准曲线计算LLOQ样本的质量浓度,根据测定结果计算其RE值、批内RSD值、批间RSD值。所有LLOQ样本测定质量浓度与理论质量浓度的RE值均不超过±20%,平均测定质量浓度与理论质量浓度的RE值不超过±20%,且批内、批间RSD值均小于15%。因此定量下限为10.0 ng/mL,定量限为3.50 ng/mL,检测限为1.06 ng/mL。
2.5.4 基质效应试验分别取6个不同来源的空白血浆,按“血浆样本的处理”项下操作,得到空白血浆基质后,再加入25.0、300、1 600 ng/mL头孢地尼对照品溶液及内标溶液,以其进样得到的峰面积除以相应质量浓度的头孢地尼对照品溶液及内标溶液直接进样得到的峰面积(每个来源血浆的峰面积分别与全部溶液样本的平均峰面积求比值),计算血浆中内源性物质对头孢地尼和内标头孢克洛的基质效应因子。结果血浆中内源性物质对25.0、300.0、1 600.0 ng/mL头孢地尼血浆样本中头孢地尼的基质效应因子见表 1。血浆中内源性物质对内标头孢克洛的基质效应因子为(105.5±2.3)%。
| 表 1 基质效应试验结果(x±s,n = 18) Table 1 Results of matrix factor test (x±s, n = 18) |
按 “血浆样本的处理”项操作,处理25.0、300、1 600 ng/mL头孢地尼的QC样本,每个质量浓度选取6个样本,连续测定3批,以同一批的标准曲线计算QC样本的质量浓度,根据测定结果计算方法的准确度和精密度,结果见表 2。所有QC样本测定质量浓度、理论质量浓度的RE值均不超过±15%,各个质量浓度的QC样本的平均测定质量浓度与理论质量浓度的RE值均不超过±15%,且批内、批间RSD值均不大于15%。
| 表 2 准确度和精密度试验结果(x±s,n = 18) Table 2 Results of precision and accuracy tests (x±s, n = 18) |
取含25.0、300、1 600 ng/mL头孢地尼的QC样本,每个质量浓度选取3个样本,分别考察人血浆室温放置2 h、血浆样本处理后于自动进样器中放置22 h、−80 ℃反复冻融3次和−80 ℃冰冻放置28 d的稳定性,结果见表 3。所有测定的质量浓度与理论质量浓度的RE值均在±15%以内。
| 表 3 稳定性试验结果(n = 3) Table 3 Results of stability test (n = 3 ) |
按“血浆样本的的处理”项操作,处理25.0、300、1 600 ng/mL头孢地尼对照品溶液血浆,每个质量浓度选取6个样本,以其进样得到的峰面积除以混合空白血浆经处理后再加入25.0、300、1 600 ng/mL头孢地尼对照品溶液及内标溶液后进样得到的峰面积,计算血浆中头孢地尼和头孢克洛的提取回收率。头孢地尼的提取回收率见表 4,血浆样本中内标头孢克洛的提取回收率为(78.1±1.0)%。
| 表 4 提取回收率试验结果(x±s,n = 18) Table 4 Results of recovery (x±s, n = 18) |
试验由航天中心医院国家药物临床试验机构Ⅰ期临床试验研究室实施,试验方案经航天中心医院伦理委员会批准。24名健康受试者均为男性,年龄(24±2)岁,身高(1.71±0.06)m,体质量(63.1±7.1)kg,体质量指数(22±2)kg/m2,试验前签署知情同意书。采用随机、双周期、自身交叉实验设计,依据受试者入组顺序将其随机分为2组,交叉服用受试制剂或参比制剂(给药剂量100 mg),清洗期为7 d。受试者于试验前1 d进食清淡晚餐后禁食,试验当日早晨空腹口服受试制剂或参比制剂。于用药前和用药后0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、7、8、10、12 h于上肢静脉取血4 mL,置肝素化试管中,4 ℃下3 500 r/min离心5 min,取血浆(血样分离过程中EP管置于冰水浴中)置−80 ℃冰箱中保存备测。
2.6.2 药动学参数采用LC-MS/MS法测定24名受试者口服受试制剂和参比制剂后血浆中头孢地尼的质量浓度,若所测质量浓度超出ULOQ,则采用二倍稀释法,取血浆50 μL,依次加相应的空白血浆50 μL,按“血浆样本的处理”项下操作处理。平均血药浓度-时间曲线见图 2。采用WinNonlin 6.3软件、非房室模型方法计算各主要药动学参数,结果见表 5。
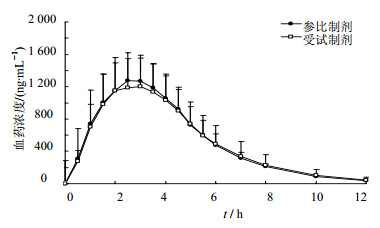 | 图 2 血浆中头孢地尼的平均浓度-时间曲线Fig.2 Mean plasma concentration - time curves of cefdinir in serum |
| 表 5 主要药动学参数 Table 5 Main pharmacokinetic parameters |
将受试制剂和参比制剂的主要药动学参数AUC0-t、AUC0-∞和Cmax对数转换后进行方差分析,采用双向单侧t检验与90%置信区间法评价和判断制剂间是否具有生物等效性。结果表明,AUC0-t、AUC0-∞的几何平均数比值(GMR)分别为97.88%、97.95%,其90%置信区间分别为91.75%~104.42%、91.76%~104.56%,在80.00%~125.00%;Cmax的GMR为96.75%,其90%置信区间为90.43%~103.52%,在75.00%~133.00%。因此认为受试制剂与参比制剂具有生物等效性。
3 讨论本研究建立了测定人血浆中头孢地尼质量浓度的LC-MS/MS法。在血浆样本处理方面,对沉淀剂的种类(甲醇、乙腈和10%三氯乙酸溶液)进行了选择,结果表明甲醇作为沉淀剂时,色谱峰展宽,头孢地尼响应降低;乙腈作为沉淀剂时,生物基质的干扰严重,影响头孢地尼的准确测定,因此,最终选择10%三氯乙酸溶液作为沉淀剂处理样本,处理方法简便、快速,血浆用量仅100 μL,且色谱峰峰形和响应良好,生物基质不干扰头孢地尼的测定。通过优化色谱条件和质谱条件,缩短了分析时间,头孢地尼和内标头孢克洛的保留时间分别约为1.97、2.10 min。
另外,在分析测定方法建立的过程中发现,血浆中头孢地尼在室温放置条件下不稳定,降解曲线见图 3。室温条件下血浆中头孢地尼在2 h内稳定,室温放置4 h后头孢地尼降解约15%,15 h后降解约50%。因此,放置温度对头孢地尼血浆样本的稳定性影响较大。实验中同时考察头孢地尼血浆样本于冰水浴中放置6 h情况下仍稳定。因此,本实验血浆样本分离过程在低温操作(置于冰水浴中),血浆样本处理在2 h内完成,以保证血浆样本中头孢地尼测定的准确性。
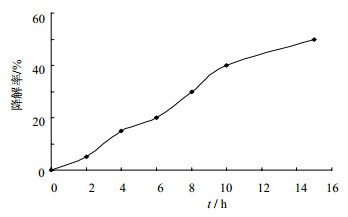 | 图 3 血浆中头孢地尼在室温放置条件下的降解曲线Fig.3 Degradation efficiency of cefdinir in human plasma at room temperature storage |
本实验完整的方法学考察确证表明,LC- MS/MS法法快速、灵敏、准确、专属性强、重现性好,适用于人血浆中头孢地尼质量浓度的测定,可应用于头孢地尼口服制剂人体药动学和生物等效性的研究。
| [1] | 张明发, 辛海涛. 头孢地尼的抗菌活性和药动学概述[J]. 上海医药, 2006, 26(6):266-270. |
| [2] | Hatano K, Nishino T. Morphological alterations of Staphylococcus aureus and Streptococcus pyogenes exposed to cefdinir, a new oral broad-spectrum cephalosporin[J]. Chemotherapy, 1994, 40(2):73-79. |
| [3] | 裴斐, 梁蓓蓓, 周晓兵, 等. 头孢地尼等5种抗菌药物对肺炎链球菌的体外抗菌活性研究[J]. 中华医院感染学杂志, 2005, 15(1):73-75. |
| [4] | 顾学章, 茆亦一. 头孢地尼的临床应用[J]. 中国新药与临床杂志, 2003, 22(12):754-756. |
| [5] | 林燕. 头孢地尼的国内外临床应用进展[J]. 中国药房, 2003, 21(4):382-384. |
| [6] | Li J, Wang L, Chen Z, et al. Development and validation of a rapid HPLC method for the determination of cefdinir in beagle dog plasma integrated with an automatic on-line solid-phase extraction following protein precipitation in the 96-well plate format[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 895-896:83-88. |
| [7] | Khan A, Iqbal Z, Khan M I, et al. Simultaneous determination of cefdinir and cefixime in human plasma by RP-HPLC/UV detection method:Method development, optimization, validation, and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(24):2423-2429. |
| [8] | 马瑞蓉, 张慧琳, 侯杰. 头孢地尼颗粒剂与胶囊的人体生物等效性[J]. 中国抗生素杂志, 2002, 27(11):677-680. |
| [9] | 张伟, 秦玉花, 赵红卫, 等. 头孢地尼口腔崩解片生物等效性研究[J]. 实用诊断与治疗杂志, 2008, 22(6):404-406. |
| [10] | 张新萍, 赵利萍, 雷光明. 头孢地尼分散片的人体生物等效性研究[J]. 中国药房, 2007, 18(32):2514-2516. |
 2015, Vol. 30
2015, Vol. 30


