2. 山东大学化学与化工学院, 山东 济南 250100;
3. 天津中医药大学研究生院, 天津 300193
2. School of Chemistry and Chemical Engineering, Shandong University, Jinan 250100, China;
3. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
痛风是由于尿酸单钠盐(MSU)在关节等部位沉积而引起的以痛疼和肿胀为主要特征的炎症性疾病,其发病前提是高尿酸血症,后者会导致尿酸慢慢沉积在关节等部位的组织中而形成痛风石。高尿酸血症一般是由于尿酸产生过多和/或尿酸排泄降低引起,其中后者约占90%[1]。痛风目前已经逐渐发展为继高血压、高血脂和高血糖后第4种代谢性疾病,其发病率正迅速增加。
尿酸转运体1(URAT1)是近年来发现的一个可用于高尿酸血症和痛风治疗的新靶点,它位于肾脏的近曲小管上,负责肾脏中大部分(约90%)尿酸的重吸收[2, 3]。lesinurad(RDEA594)是Ardea Biosciences在抗病毒药物REDA806的基础上发展而来的第一代URAT1抑制剂(lesinurad是RDEA806的体内代谢产物)[4, 5, 6],目前已经在欧盟递交了上市申请。本课题组在前期研究中也对其合成工艺进行了研究[7];Ardea Biosciences后来在lesinurad的基础上进一步进行结构优化得到了新一代的URAT1抑制剂RDEA3170,后者相比前者具有更强的药效和更加优异的URAT1选择性[8]。
RDEA3170的合成方法文献报道较少[9, 10],且工艺描述不清楚或不完整,多步反应难以重复。因此,本课题组对RDEA3170的合成路线进行了系统研究,确定了一条实用的合成路线,见图 1;在此过程中,对其中重要的3步反应步骤进行了深入的研究,获得了最优的反应条件。
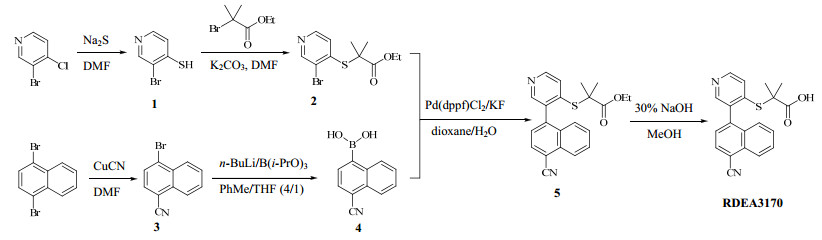 | 图 1 RDEA3170的合成路线Fig.1 Synthetic route of RDEA3170 |
RY-2显微熔点测定仪(天津天光光学仪器有限公司);Bruker AV 400 MHz型核磁共振仪(瑞士Bruker公司);Thermo Finnigan LCQ Advantage MAX型质谱仪。3-溴-3-氯吡啶(南京爱里凯德化工有限公司,98%)和1,4-二溴萘(南京盛必诚化工科技有限公司,98%)均为市售,使用前未经进一步提纯。干燥的甲苯和THF是以二苯甲酮作指示剂从金属钠中蒸馏获得。
2 方法与结果 2.1 3-溴吡啶-4-硫醇(1)的合成一只2 L的圆底烧瓶中加入3-溴-4-氯吡啶(19.24 g,100 mmol)、Na2S·9H2O(72.05 g,300 mmol)和700 mL DMF,所得混合物在氮气气氛中100 ℃下加热搅拌,醋酸乙酯-石油醚(1∶6)为展开剂,TLC监测反应(通常需要2 h)。反应完成后,反应混合物冷却后,倾倒入2 L冰水中,搅拌,所得黄色混合物用CH2Cl2(500 mL×2)萃取,弃去有机相。水相再用浓盐酸调节pH值至5~6,得到黄色浆状物,室温下搅拌1 h,抽滤收集固体。得到的滤饼在45 ℃下真空干燥,得到化合物1的粗品,黄色固体12.16 g,收率为64%。该粗品不用纯化即可直接用于下一步反应。少量粗品1经过硅胶柱色谱纯化,用醋酸乙酯-甲醇(10∶1→10∶3)梯度洗脱,得到纯品1,黄色固体。mp 169.5~171 ℃;1H-NMR(400 MHz,DMSO-d6)δ:12.83(bs,1H,SH),8.29(d,1H,J=0.8 Hz,Ar-H),7.59(dd,1H,J=0.8、6.8 Hz,Ar-H),7.41(d,1H,J=6.8 Hz,Ar-H)。上述数据与文献报道[11]基本一致。
2.2 2-((3-溴吡啶-4-基)硫)-2-甲基丙酸乙酯(2)的合成一只1 L的干燥的圆底烧瓶中加入上述制备的粗品1(11.40 g,60 mmol),以250 mL DMF溶解,室温下搅拌。而后依次加入固体K2CO3(24.88 g,180 mmol)和2-溴-2-甲基丙酸乙酯(14.04 g,72 mmol),室温下搅拌,醋酸乙酯-石油醚(1∶1)为展开剂,TLC监测反应(通常需要5 h)。反应完成后,反应混合物倾倒入1.2 L冰水中,搅拌,用CH2Cl2(300 mL×3)萃取。合并有机相,用5%的饱和氯化钠水溶液500 mL洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱纯化,醋酸乙酯-石油醚(1∶5)洗脱,得到化合物2的纯品,无色液体20.99 g,收率为92%。ESI-MS m/z 304.05[M(79Br)+H]+、306.01 [M(81Br)+H]+。1H-NMR(400 MHz,DMSO-d6)δ:8.69(s,1H,Ar-H),8.46(d,1H,J=5.2 Hz,Ar-H),7.26(d,1H,J=5.2 Hz,Ar-H),4.13(q,2H,J=7.1 Hz,OCH2CH3),1.61(s,6H,CMe2),1.12(t,3H,J=7.0 Hz,OCH2CH3);13C-NMR(100 MHz,DMSO-d6)δ:172.42,151.28,148.12,145.35,124.62,121.84,61.64,50.91,25.64,13.70。
2.3 4-溴-1-苯腈(3)的合成一只1 L的干燥圆底烧瓶中加入1,4-二溴萘(57.19 g,200 mmol)、CuCN(10.75 g,120 mmol)和600 mL DMF,所得混合物在氮气气氛中130 ℃下搅拌12 h。反应混合物冷却到室温,转移到一只5 L的烧瓶中,加入1.8 L醋酸乙酯,室温下搅拌2~3 h,得到灰褐色浆状物。抽滤,收集滤液,滤饼用少量醋酸乙酯洗涤,洗涤液合并到滤液中。滤液用水(1 L×5)洗涤,无水硫酸钠干燥,旋转蒸发仪蒸去溶剂,得到的黄色固体中加入400 mL醋酸乙酯-石油醚(1∶3),升温至70 ℃,搅拌,得到一澄清溶液。该溶液在搅拌下慢慢冷却到室温后,得到黄色浆状物,抽滤收集滤液,在旋转蒸发仪上蒸干,得到的残余物经硅胶柱色谱纯化,用醋酸乙酯-石油醚(1∶50→1∶30)洗脱,得到化合物3的纯品,白色固体12.53 g,收率为27%。mp 103~104 ℃;1H-NMR(400 MHz,DMSO-d6)δ:8.26~8.31(m,1H,Ar-H),8.13~8.18(m,1H,Ar-H),8.07(s,2H,Ar-H),7.85~7.92(m,3H,Ar-H)。上述数据与文献报道[12]基本一致。
2.4 (4-氰基萘-1-基)硼酸(4)的合成一只干燥的500 mL圆底烧瓶中,加入化合物3(11.60 g,50 mmol)和硼酸三异丙酯(18.81 g,100 mmol),以230 mL干燥的甲苯和46 mL干燥的THF溶解,氮气吹扫后,以橡胶软塞封口,启动电磁搅拌,冷却到−30 ℃。通过注射器慢慢滴加1.6 mol/L n-BuLi(37.5 mL,60 mmol),滴加完毕后,反应混合物在该温度下搅拌2~3 h,再慢慢滴加50 mL 2 mol/L的稀盐酸。滴加完毕后,反应混合物在室温下搅拌1 h。反应混合物倾倒入500 mL冰水中,搅拌,分出有机相,水相再用甲苯(200 mL×3)萃取。合并有机相,用200 mL 5%的饱和氯化钠水溶液洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸去溶剂,得到的残余物中加入100 mL醋酸乙酯-石油醚(1∶5),室温下搅拌过夜,抽滤收集滤饼,室温下真空干燥,得到化合物4的粗品,白色固体8.27 g,收率为84%;该粗品难以提纯,可以直接用于下一步反应,而不用进一步纯化。
2.5 2-((3-(4-氰基萘-1-基)吡啶-4-基)硫)-2-甲基丙酸乙酯(5)的合成一只500 mL的圆底烧瓶中加入化合物2(12.17 g,40 mmol)、化合物4(8.67 g,44 mmol)、Pd(dppf)Cl2(1.46 g,2 mmol)、固体KF(9.30 g,160 mmol)、180 mL 1,4-二氧六环和20 mL水,所得混合物在氮气气氛中回流12 h。反应混合物冷却后,倾倒入500 mL冰水中,搅拌,用CH2Cl2(300 mL×3)萃取。合并有机相,用200 mL 5%的饱和氯化钠水溶液洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸去溶剂,得到的残余物经过硅胶柱色谱纯化,醋酸乙酯-石油醚(1∶3)洗脱,得到化合物5的纯品,白色固体12.80 g,收率为85%。mp 117~119 ℃;ESI-MS m/z 377.14 [M+H]+;1H-NMR(400 MHz,DMSO-d6)δ:8.64(d,1H,J=5.2 Hz,pyridine-H),8.42(s,1H,pyridine-H),8.26(d,1H,J=7.6 Hz,Ar-H),8.22(d,1H,J=8.0 Hz,Ar-H),7.84(t,1H,J=7.8 Hz,Ar-H),7.67(t,1H,J=7.6 Hz,Ar-H),7.57(d,1H,J=7.2 Hz,Ar-H),7.40~7.42(m,2H,Ph-H、pyridine-H),4.08(q,2H,J=7.1 Hz,OCH2CH3),1.38(s,6H,SCMe×2),1.12(t,3H,J=7.0 Hz,OCH2CH3);13C-NMR(100 MHz,DMSO-d6)δ:172.81,149.83,149.41,144.34,139.88,134.36,132.60,131.51,131.17,129.21,128.35,127.57,126.16,124.81,123.77,117.34,109.52,61.44,50.56,25.91,25.79,13.73。
2.6 2-((3-(4-氰基萘-1-基)吡啶-4-基)硫)-2-甲基丙酸(RDEA3170)的合成一只250 mL的圆底烧瓶中加入化合物4(7.53 g,20 mmol),以50 mL甲醇溶解,搅拌,加入30% NaOH(5.33 mL,40 mmol)溶液,而后升温回流1 h,反应混合物冷却后,倾倒入200 mL冰水中,搅拌,用浓盐酸调节pH值至6~7,所得混合物用醋酸乙酯(100 mL×5)萃取。合并有机相,用5%饱和氯化钠水溶液200 mL洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸去溶剂,得到的残余物中加入30 mL醋酸乙酯-石油醚(1∶10),室温下搅拌过夜,抽滤收集滤饼,室温下真空干燥,获得RDEA3170的纯品,白色固体5.71 g,收率为82%。mp 206 ℃;ESI-MS m/z 347.09 [M-H]−。1H-NMR(400 MHz,DMSO-d6)δ:13.12(bs),8.63(d,1H,J=4.0 Hz,pyridine-H),8.39(s,1H,pyridine-H),8.26(d,1H,J=7.6 Hz,Ar-H),8.22(d,1H,J=8.4 Hz,Ar-H),7.84(t,1H,J=7.6 Hz,Ar-H),7.67(t,1H,J=7.4 Hz,Ar-H),7.58(d,1H,J=7.2 Hz,Ar-H),7.50(d,1H,J=5.2 Hz,pyridine-H),7.41(d,1H,J=8.4 Hz,Ar-H),1.39(s,3H,SCMe),1.36(s,3H,SCMe);13C-NMR(100 MHz,DMSO-d6)δ:174.65,149.67,149.28,145.16,139.96,134.00,132.65,131.51,131.18,129.19,128.35,127.51,126.18,124.81,123.22,117.37,109.49,50.56,26.00,25.77。上述数据与文献报道[9, 10]基本一致。
3 讨论 3.1 化合物1和2的合成原料3-溴-4-氯吡啶与Na2S·9H2O在DMF中氮气气氛里100 ℃下加热,发生芳香亲核取代反应,选择性将氯原子转变为巯基,得到化合物1。需要指出的是,Na2S使用的是其9水合物(Na2S·9H2O)而不是无水物,因为后者价格昂贵。实验证明Na2S·9H2O中存在的水分子对整个反应影响不大。化合物1的极性很大、溶解性较差,不利于柱色谱提纯,实验证明粗品1可以直接用于下一步的反应。粗品1与2-溴-2-甲基丙酸乙酯在固体K2CO3存在下在DMF中室温下反应,顺利得到产物2。
3.2 化合物3的合成原料1,4-二溴萘与0.6 mol CuCN在DMF中氮气气氛中130 ℃下加热,发生芳香亲核取代反应,其中一个溴原子被取代,生成化合物3。1,4-二溴萘与CuCN反应时,生成的单取代产物3在反应条件下仍然会与CuCN继续反应从而产生二取代产物1,4-萘二腈(6),而原料1,4-二溴萘也有剩余的可能性,见图 2。因此,为了研究CuCN的用量对本反应产物分布的影响以期获得最高产率的期望产物3,对CuCN的量做了详细的研究,见表 1。随着CuCN量的增加(0.4 mol→1.6 mol),回收的未反应的1,4-二溴萘逐渐减少,副产物6的产率逐渐增加,而期望产物3的收率则出现先升后降趋势,最高产率出现在CuCN为0.6 mol时。需要指出的是,在产物中3个组分均存在,但3个组分的溶解度存在差异,并且在一般有机溶剂中溶解度顺序为6<3<1,4-二溴萘。基于这3个化合物溶解度的差别,三者的混合物首先使用醋酸乙酯-石油醚(1∶3)进行重结晶,除去溶解性最差的副产物6,然后再将未反应的原料和期望产物3的混合物使用柱色谱纯化,从而达到分离的目的。
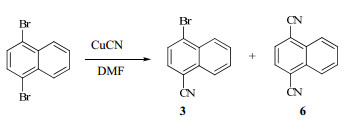 | 图 2 1,4-二溴萘与CuCN反应的副产物Fig.2 Byproduct in the reaction of 1,4-dibromo- naphthalene and CuCN |
| 表 1 1,4-二溴萘与CuCN反应时CuCN量的筛选 Table 1 Screening of equivalent of CuCN in the reaction of 1,4-dibromonapgthalene and CuCN |
化合物3与2 mol硼酸三异丙酯的混合物在干燥的甲苯/THF(4∶1)的混合物中冷却至−30 ℃,慢慢滴加n-BuLi来引发反应,得到的芳基硼酸二异丙酯中间体用酸处理,得到期望产物4。当n-BuLi滴加到化合物3和硼酸三异丙酯的混合物中时,n-BuLi先与溴化物3反应,生成的4-氰基-1-萘基锂中间体被硼酸三异丙酯“原位淬灭”[13],从而最终得到期望的化合物4。这一结果与文献报道[11]的“原位淬灭”工艺一致。RDEA3170的文献[9, 10]中并未报道化合物4的合成方法,因此在开始时尝试使用了传统的芳基硼酸合成工艺(芳基卤化物先与n-BuLi或i-PrMgCl反应,得到的芳基锂中间体再与后加入的硼酸酯反应)[14],但是没有成功,结果显示n-BuLi与化合物3先反应时也会同时进攻CN而导致产物混乱,几乎得不到产物;尝试将化合物3先与Knochel格式试剂(i-PrMgCl·LiCl)反应[15],得到的4-溴-1-萘基氯化镁中间体再与后加入的硼酸三异丙酯反应,结果也不理想,确实观察到有期望产物4生成,但是收率很低且伴随着很多难以除去的副产物;尝试使用溴化物3与联硼酸频那醇酯反应生成芳基硼酸4可能的替代产物7时,结果也不理想,因为期望产物7的产率很低,有大量自身偶合而导致的副产物8伴随生成,见图 3。产物4很难获得高纯的样品用于结构表征,可能存在部分的三聚现象[13],但是正如文献[13]所述,这种三聚现象并不影响4在后面Suzuki偶合中的使用,因此粗品4没有纯化,而是直接用于了下一步反应。
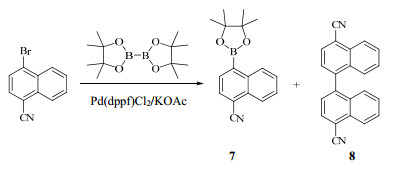 | 图 3 化合物3和联硼酸频那醇酯合成化合物7的尝试Fig.3 Attempt to synthesize compound 7 from compound 3 and bis(pinacolato)diboron |
溴化物2和萘基硼酸4在0.05 mol Pd(dppf)Cl2作催化剂、4 mol KF作碱条件下在1,4-二氧六环/ H2O(9/1)中氮气保护下回流,顺利反应,得到化合物5。RDEA3170的合成文献[9, 10]使用了Na2CO3作为碱,但是该结果很难重现,于是对该反应的碱展开了系统的研究,见表 2。在1,4-二氧六环/水中使用经典的Suzuki偶合反应的碱(Na2CO3、K2CO3和K3PO4)时,反应并不发生,即使更换了几种常见的溶剂系统也无济于事。在这3种碱存在下,在含水溶剂中回流反应时,不仅化合物2和4没有发生Suzuki偶合反应,而且溴化物2中的酯基也没有水解,由此可以推断酯基邻位的偕二甲基基团的位阻非常大,它可以阻碍酯在该条件下的水解,同时该位阻可能也阻止了在经典的Suzuki偶合反应所使用的碱的存在下化合物2和4的反应。鉴于此,尝试了使用活性更强的氟化物作为碱来活化芳基硼酸酯以期促进该反应[16],在固定Pd(dppf)Cl2催化剂为0.05 mol时,当KF从1 mol增加到4 mol时,产物5的收率逐渐上升,在KF为3 mol时基本达到顶峰,说明氟化物对芳基硼酸的活化能力比Na2CO3之类的经典碱要强得多。为了稳妥起见,最终选择KF的最佳量为4 mol。固定KF为4 mol时,将Pd(dppf)Cl2催化剂的量由0.05 mol增加为0.1 mol时,产物5的产率基本没有变化。固定KF为4 mol、Pd(dppf)Cl2催化剂为0.05 mol,将KF更换为CsF时,产物5的产率也基本没有变化,由于CsF的价格远比KF昂贵,因此最终选择KF。综上所述,化合物2和4发生Suzuki偶合的最佳反应条件为化合物4/2的物质的量比为1.1、4 mol KF、0.05 mol Pd(dppf)Cl2,使用1,4-二氧六环/H2O(9/1)作为溶剂,在氮气保护下回流12 h。
| 表 2 化合物2和4发生Suzuki偶合反应时反应条件的筛选 Table 2 Screening of reaction conditions of the Suzuki coupling of compounds 2 and 4 |
化合物5在回流的MeOH中用NaOH溶液水解,顺利得到RDEA3170,其1H-NMR数据与文献报道[9, 10]基本一致,13C-NMR和MS与结构一致。
综上所述,利用3-溴-4-氯吡啶和1,4-二溴萘作为起始原料经过6步反应合成了RDEA3170,总收率为16%,对化合物3、4、5合成的反应条件进行了详细优化和研究,得到了最优的反应条件。
| [1] | Punzi L, Scanu A, Ramonda R, et al. Gout as autoinflammatory disease:new mechanisms for more appropriated treatment targets[J]. Autoimmun Rev, 2012, 12(1):66-71. |
| [2] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels[J]. Nature, 2002, 417(6887):447-452. |
| [3] | Burns C M, Wortmann R L. Gout therapeutics:new drugs for an old disease[J]. Lancet, 2011, 377(9760):165-177. |
| [4] | Singh J A. Emerging therapies for gout[J]. Expert Opin Emerg Drugs, 2012, 17(4):511-518. |
| [5] | Moyle G, Boffito M, Stoehr A, et al. Phase 2a randomized controlled trial of short-term activity, safety, and pharmacokinetics of a novel nonnucleoside reverse transcriptase inhibitor, RDEA806, in HIV-1-positive, antiretroviral-naive subjects[J]. Antimicrob Agents Chemther, 2010, 54(8):3170-3178. |
| [6] | 耿艳艳, 于冰, 徐为人, 等. 新型痛风治疗药物lesinuard sodium[J]. 现代药物与临床, 2014, 29(6):685-689. |
| [7] | 田禾, 蔡文卿, 谢亚非, 等. lesinurad的合成工艺研究[J]. 现代药物与临床, 2015, 30(1):1-7. |
| [8] | Diaz-Torné C, Perez-Herrero N, Perez-Ruiz F. New medications in development for the treatment of hyperuricemia of gout[J]. Curr Opin Rheumatol, 2015, 27(2):164-169. |
| [9] | Ardea Biosciences Inc. Thioacetate compounds, compositions and methods of use[P]. US:20130281469, 2013-10-24. |
| [10] | Ardea Biosciences Inc. 3,4-Disubstituted pyridine compounds, methods of using and compositions comprising the same[P]. WO:2013067425, 2013-05-10. |
| [11] | Trecourt F, Queguiner G. Synthesis of xanthones and thioxanthones having two heteroaromatic rings[J]. J Chem Res Synopses, 1982(3):76-77. |
| [12] | Cakmak O, Kahveci I, Demirta I, et al. Bromination of tetralin. short and efficient synthesis of 1,4-dibromonaphthalene[J]. Collect Czech Chem Commun, 2000, 65(11):1791-1804. |
| [13] | Li W, Nelson D P, Jensen M S, et al. An improved protocol for the preparation of 3-pyridyl-and some arylboronic acid[J]. J Org Chem, 2002, 67(15):5394-5397. |
| [14] | Boardman F H, Dunmur D A, Grossel M C, et al. Synthesis and liquid crystal phase behaviour of 2-(4-cyanophenyl)-7-n-alkylfluorenes:luminescent mesogens[J]. Chem Lett, 2002, 31(1):60-61. |
| [15] | Leermann T, Leroux F R, Colobert F. Highly efficient one-pot access to functionalized arylboronic acids via noncryogenic bromine/magnesium exchanges[J]. Org Lett, 2011, 13(17):4479-4481. |
| [16] | Li L, Mathieu M C, Denis D, et al. The identification of substituted benzothiophene derivatives as PGE2 subtype 4 receptor antagonists:from acid to non-acid[J]. Bioorg Med Chem Lett, 2011, 21(2):734-737. |
 2015, Vol. 30
2015, Vol. 30


