新药研发必须遵守“安全、有效、质量可控”的基本原则。秉承“科学设计、规范生产、过程监控及制定合理的药品质量标准”等原则能够保证药物的质量可控。在药物质量研究过程中,除了关注活性成分的指标外,近年来对其杂质和有毒、有害物质的研究越来越重视[1]。药物中的杂质简单地可以分为有关物质(有机杂质)、残留溶剂、金属杂质、晶型杂质、异构体杂质、基因毒性杂质及其他一些特定的物质。这些物质一般没有治疗作用,有的还具有一定的毒性,尤其是基因毒性杂质,是影响药物安全性的主要因素。药品在临床使用中产生的不良反应除了与药品本身的药理活性有关外,有时与药品中存在的杂质也有很大关系。对于原料药的杂质,一般来源于起始物料及反应容器、试剂、催化剂、反应溶剂、中间体、副产物等;而制剂中的杂质主要来源于辅料、溶剂、降解产物、包装器皿中可提取或渗出的杂质等。中药常见的杂质包括农药残留、重金属残留、黄曲霉素类、二氧化硫、大孔树脂残留溶剂等。抗生素类的药物因来源复杂导致其杂质比较特殊。在国家食品药品监督管理总局药品审评中心技术审评中,质量模块较多的问题都聚焦在“杂质限度制定的依据或合理性”上,而“限 度制定”往往又是方法开发与验证的前提,非常重要,本文综述了近年来药物中杂质及有害物质在设定控制限度方面的研究进展。
1 杂质限度阈值的设定 1.1指导原则
各国或组织就杂质的限度论证先后出台了多项指导原则,核心是要求药物中的杂质应该能够被很好地控制,并尽可能地将其去除,见表 1。杂质的研究也经历了纯度控制→杂质控制→杂质谱控制的阶段。
| 表 1 杂质研究的相关指导原则 Table 1 Related guidelines on impurity research |
1.2 杂质限度
人用药品注册技术要求国际协调会(ICH)定义杂质的界定或论证为“杂质的界定是获得和评估一些数值的过程,这些数值用于建立安全的阈值,单个的或某些已明确的杂质量在这个阈值水平下是可以确保生物安全性的。申报者应对所选定的杂质限度提供包括安全性研究在内的理由”。医药行业内一般可以从以下方面进行杂质的界定或论证[28, 29, 30, 31, 32, 33, 34, 35, 36, 37]:
(1)从临床研究或预试验研究的数据获得;
(2)从科学文献中获得数据;
(3)该杂质也存在于已上市的产品中,间接证明;
(4)该杂质是活性成分的代谢物;
(5)如果是仿制药,可以从比对的数据中寻找依据,如药典限度、原研产品的限度;最好做到鉴定阈值以下,超过鉴定阈值杂质,在结构确认取得相应杂质对照品后,应用外标法重新定量,以判断是否超过界定阈值。分析杂质的化学结构,看是否具有“警示结构或官能团”;
(6)进行杂质的毒理学研究。
在进行杂质限度的设定中,要充分考虑杂质毒理学研究的数据、药品的适应症、日剂量、治疗持续的周期等方面。对于新原料药和制剂的杂质控制限度可依据ICH[3, 4],见表 2。
| 表 2 新原料药和制剂的杂质控制限度 Table 2 Control limit of impurities in new drug substances and products |
ICH提供的杂质研究指南仅适用于化学合成的原料药及制剂,不适用于生物制品、发酵或半合成产品、中药以及来源于动植物的粗制品;不适用于从新药制剂的辅料或包装容器中渗出产生的杂质,不包括外源性污染物、多晶型和对映体杂质。
抗生素活性物质由化学合成工艺、发酵工艺或先采用发酵工艺,后采用一步或多步化学步骤(半合成物质)来生产,与合成工艺比较,发酵工艺更易于变异而不容易控制,其杂质分布情况可能更复杂和不可预测。
对于发酵类或半合成类抗生素药物的杂质限度制定,EMEA出台了相应的指导原则[7],见表 3。
| 表 3 抗生素类药物的杂质控制限度 Table 3 Control limit of impurities in antibiotics |
1.3 常用的杂质限度计算公式或评估方法
常用的杂质限度计算公式见表 4。
| 表 4 杂质可接受限度的计算公式 Table 4 Formula of acceptable limit for impurities |
日允许接触剂量(PDE)即某物质被人或动物接触后,任何反应频率或严重性在生物学上无明显增加的最高剂量。残留溶剂限度计算的PDE公式中,如果未观察到反应的剂量(NOEL)未知,可以用最低观察反应剂量(LOEL)代替,即某种物质被人体或动物接触后,任何反应频率或严重性在生物学上明显增加的最低剂量。NOEL的确定,一方面根据相应动物试验的资料确定,另一方面可以参考网上的数据库[39, 40, 41, 42],另有文献报道,NOEL可根据下列公式NOEL=LD50×70/2 000计算[43]。
毒理学关注阈值(TTC)是一种新的风险评估工具,有助于毒性的评估。TTC定义了一个安全的阈值水平,当人体暴露水平低于该阈值时,化合物不会产生明显的致癌性或其他毒性反应。根据取得TTC值数据库的性质,TTC原则不适用于评价重金属(如砷、镉、铅和汞)、具有极端长半衰期和在生物累积过程中表现出很大的种属差异的化合物、蛋白质[44]。对于参数TD50,可以从试验、文献、网站[45]等途径获得。如未有TD50报道,且未有特别说明,TTC可以制定为1.5 μg/d。
2 一些特定领域或典型物质的残留限度的研究 2.1 基因毒性杂质
一般性的及ICH杂质研究指南并不适用于具有遗传毒性或基因毒性的杂质。基因毒性的杂质应该在工艺路线中避免设计或产生,如果不可避免,应该将其降低到一定的限度。
EMEA、FDA等组织出台了相关的基因毒性杂质控制的技术指南。对于短期用药,EMEA指南中的限度见表 5。FDA接受EMEA上述指南,提出了临床研究阶段药物的限度,见表 6。
| 表 5 EMEA对基因毒性杂质的控制限度 Table 5 Control limit of genotoxic impurities by EMEA |
| 表 6 FDA对基因毒性杂质的控制限度 Table 6 Control limit of genotoxic impurities by FDA |
有些化合物,摄入量即便低于其TTC,其遗传毒性也很强,如黄曲霉素类、N-硝基化合物、偶氮化合物等,需要进行杂质的毒理学研究。
中间体杂质有警示结构的,应分情况对待:
(1)如果原料也含有相同的结构(一般的抗肿瘤药物),如卡培他滨,其中间体含有氨基甲酸酯的警示结构,那么原料成品中的中间体杂质可以按照ICH Q3A控制即可;
(2)如果原料不含有警示结构,而中间体有,则中间体在原料中的残留情况需要按照基因毒性杂质控制,如某药物合成时与对甲苯磺酸成酯,而经水解后脱掉对甲苯磺酸形成活性成分;
(3)合成路线中用到了磺酸或磷酸结构的物质如同时用到了低分子的醇,也要考虑成酯的情况是否会产生基因毒性杂质。
美国药品研究和生产商协会PhRMA成立了一个工作小组来讨论遗传毒性杂质,成果以意见书的形式发表在《监管毒理学和药理学》杂志中[46],文件引入了两个重要的创新理念,一是遗传毒性杂质的五级分类系统,二是临床试验材料的分期TTC概念。基于该分类系统,该文件提出了一个杂质评估策略,成为业内大多遗传毒性杂质相关风险评估的标准。分期TTC意味着可以根据剂量和临床试验的持续时间对其进行调整,使得剂量增加时TTC降低,持续时间较短时TTC提高。
综合各类指导原则,对于基因毒性杂质的控制基本形成了以下思路:
(1)分析其合成路线,并利用遗传毒性数据或警示结构存在与否鉴定潜在的遗传毒性杂质。而TTC则是风险评估的最终决策依据。图 1~3分别列出了芳香族化合物、烷烃和环烷烃类化合物、含杂原子化合物等常见的警示具有基因毒性的化学结构或官能团[47, 48]。图 4中展示了评估和处理潜在遗传毒性杂质的推荐步骤。
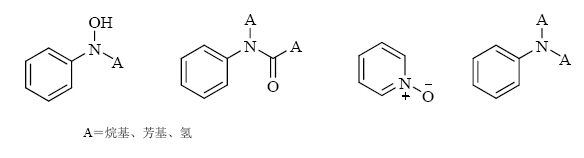
|
图 1 芳香族化合物的化学结构或官能团 Fig. 1 Chemical structures or functional groups of aromatic compounds |
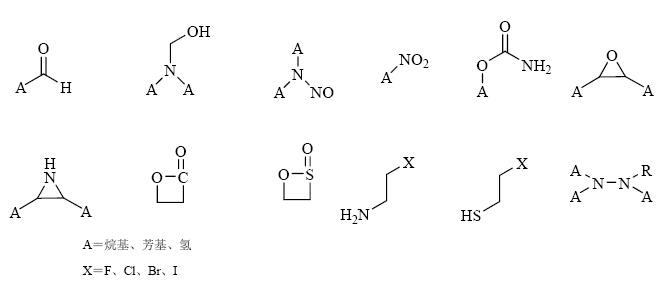
|
图 2 烷烃和环烷烃类化合物的化学结构或官能团 Fig. 2 Chemical structures or functional groups of alkanes and naphthenic compounds |
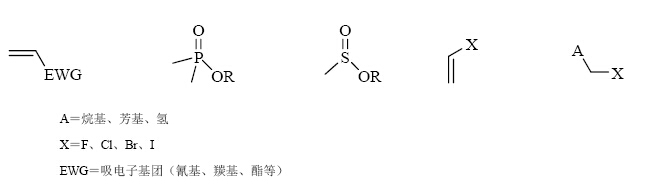
|
图 3 含杂原子化合物的化学结构或官能团 Fig. 3 Chemical structures or functional groups of compounds with heteratom |
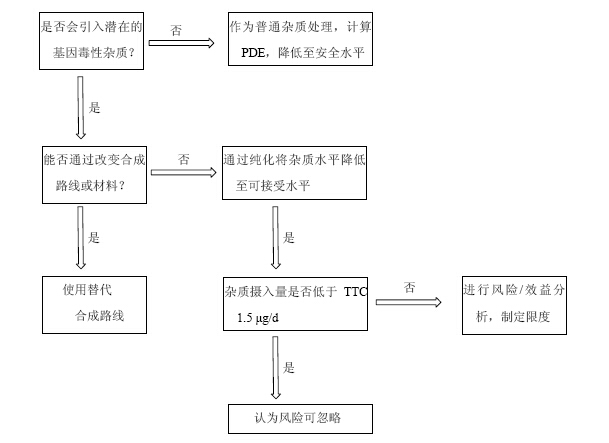
|
图 4 评估遗传毒性杂质可接受限度的决策树 Fig. 4 Decision tree of risk assessment on acceptable limit for genotoxic impurities |
(2)确认临床试验中短期用药的每日允许摄入量。
(3)论证药物基因毒性杂质残留限度以使用严谨或更合理的阈值。
(4)将第一步中鉴定的杂质进行分类,并分别为每类进行限度论证。
2.2 残留溶剂
在ICH及其他国家的指南中,药物中的残留溶剂分为3类;一类溶剂应避免使用;二类溶剂应限制使用,残留量符合PDE;三类溶剂如暴露量不超过50 mg/d,那么对人体基本无危害。
表 1已列出了残留溶剂限度的计算公式,实际应用中可以选择不同的计算公式合理地扩大或紧缩限度。如乙腈的允许日接触量为4.1 mg/d,假定日给药剂量为10 g,由此计算的限度是4.10×10−4。现某片剂最大日剂量为5.0 g,含两种辅料。片剂的成分和计算得到的最大乙腈量见表 7。
| 表 7焦油分析方法 Table 7 Example for calculating limit of residual solvents |
辅料1中乙腈的量低于4.10×10−4,但原料、辅料2和片剂的乙腈残留量均高于4.10×10−4,但片剂的乙腈日摄入量低于规定的4.1 mg,因此,符合指导原则的建议值。
对于一些未列入ICH类别的溶剂,除了采用毒理数据计算外,也可以借鉴一些经验数值:
(1)三乙胺在原料药中的残留量可以控制在3.20×10−4[49];
(2)对于ICH指出的二甲苯残留,如未有特殊说明,可以计算邻、间、对二甲苯残留之和;
(3)石油醚是由低分子烷烃组成的混合物,其组成比例没有确定性。在ICH指导原则和《中国药典》2010年版附录中都将石油醚列为没有足够毒性资料的第四类溶剂,要求药品生产企业在使用时应提供该类溶剂残留水平的合理性论证报告。文献报道,以石油醚的各主要组分峰面积的加和计算方式来表示石油醚的残留量,可以有效控制石油醚在药物中的残留量[50];
(4)对于大孔树脂的溶剂残留量,苯乙烯骨架型大孔吸附树脂残留物检查项目暂定为[51]:苯、甲苯、二甲苯、苯乙烯、烷烃类、二乙基苯类(二乙烯基)等残留物的限度定为苯小于2×10−6、其他小于2×10−5。但是,应用大孔树脂的药品安全性也同其他药品一样,在上市前应根据临床前和临床安全性研究的情况综合评价,也可以参考ICH,同时考虑给药途径等因素;
(5)对于残留溶剂色谱图中的未知峰,可制订限度不得过0.1%。
2.3 重金属
重金属杂质是一类自然存在的杂质,可能是工艺需要有意使用了金属化合物或在生产现场接触到金属元素,导致在终产品中残留。如基于安全性和质控的需要,原料或辅料合成中用到的金属催化剂或金属试剂,如钯、铂、锌、铁、铬等需要进行严格控制。
对于药物中常规性的重金属检查,各国药典均制定了比色法进行半定量控制,即在pH 3.5条件下,通过硫离子或其他试剂与铅、铜、银、汞、镉等重金属离子反应生成黑色硫化物沉淀[19, 20]。通过与含有已知量铅的对照溶液的比较进行样品的重金属检查。尽管本方法对不同重金属的灵敏度不同,但总的“重金属”量是以铅量计。2011年版《欧洲药典》指出了不同情况下的重金属残留限度[27],见表 8。
| 表 8 以比色法计算的重金属限度 Table 8 Limit of heavy mental evaluating by colorimetry |
但是,经典的重金属限度检查法存在一定的局限性,体现在以下几个方面:(1)常规法基于目测比较,误差较大;(2)常规法是基于供试品中所有重金属元素之和,无法单独定量特定元素的量;(3)在一些地区和国家,硫代乙酰胺因安全和环保原因被禁止使用,以致常规法受限。在这种背景下,ICH Q3D、USP35<232>提出了金属杂质的指导原则。元素杂质包括可能会存在于原料药、辅料或制剂中的催化剂和环境污染物,在检测方面,处理传统的原子吸收分光光度法外,一些新的检测手段应运而生,如ICP-OES、ICP-MS可以同时定量测定多种金属元素的含量。这些方法各具特色,比对情况及被《中国药典》2010年版的收录评价[52]见表 9。
| 表 9 各种元素分析方法的适用性 Table 9 Suitability of different elemental analysis methods |
在质量标准设定上,首先应根据药品生产中起始物料、原料、辅料或试剂中存在的,或在生产过 程中可能引入的元素种类及其允许日摄入量,来设定药品中需要被检测的元素。其次,应对含元素杂质的药物的不同给药途径区别对待[21]。
USP232对制剂中的元素杂质的控制限度见表 10。
| 表 10 药物制剂中金属杂质控制限度 Table 10 Control limit of elemental impurities in drug products |
制剂样品中每一元素的量应不超过日剂量允许日暴露量。构成制剂的原料和辅料中每个元素加和的结果应不超过日剂量允许最大暴露值。
| 表 11 原料药和辅料中的金属杂质控制限度 Table 11 Control limit of elemental impurities in drug substances and excipients |
在表 11中提供了不同给药方式下日剂量不超过10 g/d的制剂生产所用药物成分(原料药和辅料)中的浓度限。这些数值是默认的浓度限值,帮助制剂生产商和其原辅料供应商对此进行讨论。化学药物金属杂质限度应用举例如下:
(1)500 mg片剂,每天服用一次,检测得片剂中砷为0.75 μg/g,通过公式计算0.75 μg/g×0.5 g/d×1=0.375 μg/d<1.5 μg/d(口服制剂砷的PDE),结果符合规定;
(2)0.250 g片剂,每天服用两次,1片/次,配方组成及含铅量分别为0.05 g API含有2.0 μg/g铅,0.1 g 辅料1含有1.0 μg/g铅,0.1 g辅料2含有10.0 μg/g铅,按公式计算,每片含铅=(0.05 g×2.0 μg/g)+(0.1 g×1.0 μg/g)+(0.1 g×10.0 μg/g)=1.2 μg Pb/片;2片/d=2.4 μg Pb/d(口服每天限度为5 μg Pb/d,片剂符合要求。
上述给定的安全性数据或限度会随着新的数据使用而更新。在药物的金属杂质分析中,ICH Q3D把金属元素分为4类:Ⅰ类元素具有明显的毒性,如砷、镉、汞、铅,各种给药途径的药物均需考察。Ⅱ类元素杂质的毒性与制剂的给药途径有关,又细分为ⅡA和ⅡB类。ⅡA类具有较高的自然丰度,需要对所有潜在来源和给药途径进行评价,这类元素包括钒、钼、硒、钴;ⅡB类如金、铊、钯、铂、银、铱、铑等,当这些元素刻意添加或使用到原料生产过程中时才需要评价其潜在来源;Ⅲ类元素如锑、钡、锂、铬、铜、锡、镍等,对于口服给药的制剂,除非该元素作为原料的一部分而刻意加入,否则无需进行安全性评级。对于注射剂和吸入制剂,任何可能引入该类元素的可能性均需进行风险评估。Ⅳ类元素如铝、硼、铁、锌、钾、钠、钙、镁等,由于其低毒性或尚未建立PDE标准,一般无需风险评估。该指南建议采用“鉴别(识别)→分析→评估→控制”4步法的思路。鉴别已知的元素杂质,找出其引入药品的潜在源头;分析确定特定元素在药物中存在的可能性;以PDE标准比较实测值与预测值的差距;最后建立并实施控制手段限度药品中的杂质。
需要特别说明的,砷和汞作为两种特殊的元素均含有两种杂质形态:有机型和复合无机型,导致毒性差异较大,无机砷大多有毒;汞限度是基于无机二价氧化态,甲基汞形式毒性最强;因此,作为中药使用的朱砂和雄黄,要注意元素形态的分析。
本文也汇总了一些特定情形的金属残留限度:
(1)中药注射液[53],按各品种最大日剂量计算,含铅、镉、砷、汞、铜分别不得超过12、3、6、2、150 μg。
(2)药用植物及制剂进出口绿色行业标准[54]规定:重金属总量不得超过20.0 mg/kg,铅、镉、汞、铜、砷分别不得超过5.0、0.3、0.2、20.0、2.0 mg/kg。
(3)对于与药品直接接触的包装材料和容器根据需要也控制金属元素,如低密度聚乙烯输液瓶的质量标准(YBB00012002)中,为了控制聚乙烯聚合中催化剂及生产管道等设备中混入金属元素,特对有毒有害的金属进行针对性检测:在“金属元素”一项要求含铜、镉、铬、铅、锡、钡均不得超过3×10−6;在“溶出物试验”中,要求钡、铜、铅、镉不得过1×10−6 ,镉、锡不得过1×10−7,铝不得过5×10−8 。
2.4 5-羟甲基糠醛
5-羟甲基糠醛(5-HMF)为葡萄糖等单糖化合物在高温或弱酸等条件下脱水而成,葡萄糖注射液其USP标准和中国药典标准分别控制不超过0.09%、0.02%。果糖注射液,英国药典标准和中国药典标准分别控制不超过0.19%、0.12%,可见我国标准更为严谨[55]。
2.5 二氧化硫
中药材经硫磺熏蒸能杀灭药材中的成虫及虫卵,抑制霉菌生长,使药材及其饮片外形上美观,容易上市销售。但因硫磺燃烧产生的二氧化硫与药材中的水分和无机盐结合,形成亚硫酸盐,被人体服用后与人体蛋白中的巯基进行结合反应,刺激消化道黏膜,出现恶心、呕吐、腹泻等中毒症状,长期服用,还可在人体内转化成强致癌物亚硝胺。
《中国药典》2010年版在附录中增加了二氧化硫残留量测定法,但对具体中药饮片品种的残留限度未作出相应规定。国家食品药品监督管理局组织制订了中药材及其饮片二氧化硫残留的限量标准,并由国家药典委员会自2011年6月10日起面向社会公开征求意见。规定山药、牛膝、粉葛、甘遂、天麻、天冬、天花粉、白及、白芍、白术、党参11种传统习用硫黄熏蒸的中药材及其饮片,二氧化硫残留量不得超过400 mg/kg;其他中药材及其饮片的二氧化硫残留量不得超过150 mg/kg。FAO/WHO制定的食品添加剂通用标准(第33届CAC大会2010年更新)规定:草药及香料中亚硫酸盐残留量“以二氧化硫计不得超过150 mg/kg;韩国食品医药品安全厅第2008-3号公告中要求,进入韩国市场销售的金银花、当归等总计266中药品种采用Monier-Williams改良法检测,限量标准要求低于30 mg/kg。而目前中国药典委员会推荐的11种药材的二氧化硫残留限度400 mg/kg及其他品种二氧化硫残留限度150 mg/kg,限度范围相对较大[56]。
在二氧化硫残留量计算的问题上,有学者研究了扣除水分按干燥品计算的方法,多批药材的平均水分量为11.3%,扣除水分后,二氧化硫的量平均增高11.3%,该结果更加合理客观[57]。
因此,如何科学合理地规定二氧化硫限度还需进一步研究。
2.6 农药
《中国药典》2010年版规定了甘草、黄芪、人参茎叶总皂苷、人参总皂苷中有机氯类农药的残留限度;《药用植物及制剂进出口绿色行业标准》规定六六六不得超过0.1 mg/kg,DDT不得超过0.1 mg/kg,五氯硝基苯不得超过0.1 mg/kg,艾氏剂不得超过0.02 mg/kg[58]。与《欧洲药典》、《美国药典》相比,《中国药典》收载的农药检查项的品种相对较少,因此,业内专家强调,中国市场上的上百种农药产品,药典规定的农药检测品种太少,标准也相当陈旧,国家明令禁止使用的农药应该被药典收录。
在制定农药最大允许残留量(MRL)时,需要兼顾产品特点和分析方法灵敏度的要求。MRL是由国际食品法典委员会或各国政府设定的允许某一农药在某农产品、食品或饲料中的最高法定允许浓度。制订程序如下:首先,根据农药的毒理学数据,评估其毒性并设定每日允许摄入量;然后,确定优良农业措施,研究农药在植物体内的残留和代谢,以及根据残留试验结果进行MRL值的推荐;最后,进行风险评估,作出同意、不同意或修改推荐MRL值的决定[59]。
2.7 中药中的真菌毒素
真菌毒素是由真菌产生的具有毒性的二级代谢产物,主要包括黄曲霉毒素、脱氧雪腐镰刀菌烯醇、展青霉素、赭曲霉毒素A、玉米赤霉烯酮等,可广泛污染农作物、植物及其副产品等。黄曲霉毒素是一种毒性极强的剧毒物质,目前少数国家和地区对中药材制定了黄曲霉素和赭曲霉素A的限量标准。《中国药典》2010年版一部及其增补本收载了桃仁、僵蚕、酸枣仁等药材黄曲霉毒素的残留限量检测(分析均采用柱后碘衍生化,荧光检测器),规定药材中黄曲霉毒素B1的量不得过5 μg/kg,黄曲霉素(B1+B2+G1+G2)含量不得过10 μg/kg。欧盟规定肉豆蔻、干姜、姜黄中的赭曲霉素A的限量为15 μg/kg,甘草根的提取物中赭曲霉素A的限量为20 μg/kg。
中药真菌毒素限量标准的制定首先基于毒理学的研究成果,在人体每日最大允许摄入量的基础上,结合用法用量以及疾病治疗中的暴露评估和危险评估,最终确定最高残留限度[60, 61]。
3 结语
药物的杂质研究伴随着研发设计、过程控制、放行检验、毒理学观察等环节,搞清楚杂质的来龙去脉是研究控制手段的前提,在制定质量标准的杂质限度时,要充分考虑杂质的量与安全性,同时关注生产工艺的科学性和经济性,统计数批产品的放行数据和稳定性研究报告,综合各因素制定杂质的可接受限度。近年来,随着新的分析检测技术的问世和推广,药物中微量的有害物质正逐渐被阐明揭示其化学结构或物质基础,在杂质的安全性研究上也涌现了一些快速筛选平台,为今后产品的质量控制奠定了基础。自2007年起,我国新药质量研究水平呈现了跨越式发展,不管是新药还是仿制药,杂质研究越来越清晰,而限度的研究既要满足当前环境下主流的法规原则,又要突出品种的个性化特点,将杂质水平与药物安全性的关联性研究透彻,这也是今后研究的方向之一。
| [1] | 张哲峰. 药物杂质研究中风险控制的几个关键问题 [J]. 现代药物与临床, 2010, 25(5): 327-333. |
| [2] | 国家食品药品监督管理局. 化学药物杂质研究技术的指导原则 [S]. 2005. |
| [3] | ICH. Q3A(R2): Impurities in New Drug Substances [S].2006. |
| [4] | ICH. Q3B(R2): Impurities in New Products [S].2006. |
| [5] | FDA. Guidance for Industry ANDAs: Impurities in Drug Products [S]. 2010. |
| [6] | 中国药典 [S]. 二部, 2010: 附录204-206. |
| [7] | EMEA. Guideline on Setting Specifications for Related Impurities in Antibiotics [S]. 2012. |
| [8] | 国家食品药品监督管理局. 化学药物残留溶剂研究技术指导原则 [S]. 2005. |
| [9] | FDA. Residual Solvents in Drug Products Marketed in the United States [S]. 2009. |
| [10] | ICH. Q3C(R5): Impurities: Guideline for Residual Solvents [S]. 2011. |
| [11] | EMEA. Guideline on the Limits of Geotoxic Impurities. Committee for Medicinal Products for Human Use [S]. 2006. |
| [12] | EMEA. Questions and Answers on the Guideline on the Limits of Genotoxic Impurities [S]. 2010. |
| [13] | FDA. Guidance for Industry, Genotoxic and Carcinogenic Impurities in Drug Substances and Products: Recommended Approaches [S]. 2008. |
| [14] | EMEA. Guideline on the Assessment of Genotoxicity of Herbal Substances/Preparations [S]. 2008 |
| [15] | ICH. M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk [S]. 2010. |
| [16] | ICH. S2(R1): Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended for Human Use [S]. 2012. |
| [17] | EMEA. Guideline on the Specification Limits for Residues of Metal Catalyst or Metal Reagents [S]. 2002. |
| [18] | EMEA. Guideline of the specification limit for residues of metal catalysts or metal reagents [S]. 2008. |
| [19] | 中国药典 [S]. 二部, 2010, 附录58. |
| [20] | USP35-NF30 [S].附录<231>, Heavy Metal, 2012: 145-146. |
| [21] | USP35-NF30 [S]. 第二增补版, 附录<232>, Elemental Impurities-Limits, 2012: 5633-5634. |
| [22] | USP35-NF30 [S]. 第二增补版, 附录<233>, Elemental Impurities-Procedures, 2012: 5634-5637. |
| [23] | ICH. Q3D: Impurities-Guideline for Metal Impurities [S]. 2013. |
| [24] | ICH. Q6A: Specifications for New Drug Substances and Products [S]. 1999. |
| [25] | 国家食品药品监督管理局. 化学药物质量标准建立的规范化过程技术指导原则 [S]. 2005. |
| [26] | ICH. Q8 (R2): Pharmaceutical Development [S]. 2009. |
| [27] | EDQM. Technical Guide for the elaboration of monographs [S]. 2011. |
| [28] | 何伍, 王海学. 浅谈药物杂质限度的制订方法 [J]. 中国医药工业杂志, 2009, 40(10): 787-790. |
| [29] | 张哲峰, 魏农农, 鲁爽. 浅谈杂质限度制定的一般原则 [J]. 中国新药杂志, 2008, 17(16): 1457-1460. |
| [30] | 黄晓龙. 对创新药研发中杂质限度确定的几点思考 [J]. 中国新药杂志, 2007, 16(2): 97-99. |
| [31] | 陈震. 有关物质的研究与新药注册 [J]. 中国医药工业杂志, 2010, 41(11): 872-876. |
| [32] | 祝清芬, 李涛, 国明, 等. 药物杂质的毒理学评价要求及进展 [J]. 中国新药杂志, 2010, 19(24): 2271-2276. |
| [33] | 张哲峰. 我国药物研发中杂质研究面临的挑战与思考 [J]. 药品评价, 2010, 7(18): 12-19. |
| [34] | 周怡. 化学药品标准中杂质控制及其限度的建立 [J]. 药物生物技术, 2010, 17(2): 181-184. |
| [35] | Jacobson-Kram D, McGovern T. Toxicological overview of impurities in pharmaceutical products [J]. Adv Drug Delivery Rev, 2007, 59(1): 38-42. |
| [36] | Martin E, Humfrey C, Teasdale A. Toxicology evaluation of impurities during small molecule drug development [J]. Toxicol Lett, 2013, 221: S255-S256. |
| [37] | Riley C M, Rosanske T W, Rabel Riley S R. Specification of Drug Substances and Products: Development and Validation of Analytical Methods [M]. Amsterdam: Elsevier Science Ltd., 2013. |
| [38] | 药典委员会. 9302中药有害残留物限量制定指导原则(2015版公示稿) [S]. 2014. |
| [39] | 中国国家科学数字图书馆. 化学学科门户 [DB/OL]. http://chemport.ipe.ac.cn/ListPageC/L71.shtml. |
| [40] | 化学物质毒性数据库 [DB/OL]. http://www.drugfuture. com/toxic/. |
| [41] | European chemical Substances Information System [DB/OL]. [2014-05-20]. http://esis.jrc.ec.europa.eu/index. php?PGM=dat. |
| [42] | 美国国家毒理学纲要 [DB/OL]. http://ntp.niehs.nih. gov/?objectid=D16D6C59-F1F6-975E-7D23D1519B8CD7A5. |
| [43] | APIC. Guidance on aspects of cleaning validation in active pharmaceutical ingredient plants [EB/OL]. (2000- 08-10) [2014-05-20]. http://apic.cefic.org/pub/pub-cleaning- validation.pdf. |
| [44] | 龙再浩, 陈小青, 马中春. 危险度评价中的毒理学关注阈值原则 [J]. 癌变•畸变•突变, 2008, 20(1): 79-81. |
| [45] | The Carcinogenic Potency Database [DB/OL]. http://toxnet.nlm.nih.gov/cpdb/index.html. |
| [46] | Müller L, Mauthe R J, Riley C M, et al. A rationale for determining, testing and controlling specific impurities in pharmaceuticals that possess potential for genotoxicity [J]. Regul Toxicol Pharmacol, 2006, 44(3): 198-211. |
| [47] | Teasdale A. Genotoxic Impurities: Strategies for Identification and Control [M]. New York: Wiley, 2010. |
| [48] | Sutter A, Amberg A, Boyer S, et al. Use of in silico systems and expert knowledge for structure-based assessment of potentially mutagenic impurities [J]. Regul Toxicol Pharmacol, 2013, 67(1): 39-52. |
| [49] | EMEA. How to limit triethylamine used in the manufacturing process [EB/OL]. (2013-08-25) [2014-05-20]. http://www.edqm. eu/en/page_630.php? rubrique=455. |
| [50] | 李平, 迟颖红, 陈东英. 药物中石油醚残留量的气相色谱检测方法学探讨 [J]. 药物分析杂志, 2008, 28(3): 427-430. |
| [51] | 国家食品药品监督管理总局药品审评中心. 再谈大孔树脂 [OL]. [2014-05-20]. http://www.cde.org.cn/dzkw. do?method=largePage&id=1259. |
| [52] | 韩鹏, 王玉, 陈民辉, 等. 关于构建药品限量元素检测体系的思考 [J]. 中国药品标准, 2013, 14(2): 83-87. |
| [53] | 中国药典 [S]. 一部. 2010. |
| [54] | 中华人民共和国外经贸行业标准药用植物及制剂进出口绿色行业标准 [J]. 中药研究与信息, 2001, 3(8): 9-10. |
| [55] | 王康蕊, 严相平. 甘油果糖注射液中5-HMF限度的研究 [J]. 药学与临床研究, 2012, 20(1): 38-39. |
| [56] | 陈睿, 刘惠军, 储忠英, 等. 上海市场13种中药饮片二氧化硫残留情况检测分析 [J]. 中国药事, 2013, 27(5): 457-459. |
| [57] | 陈玉武, 贺学锋, 高晓昱, 等. 完善中药材二氧化硫残留量测定方法及限量标准的建议 [J]. 中国药事, 2012, 26(6): 605-610. |
| [58] | 杨东花, 刘峰, 黄壮壮, 等. 中药外源性有害物质控制标准及其去除方法研究进展 [J]. 陕西中医, 2012, 33(5): 629-632. |
| [59] | 季申. 中药材中农药残留检测方法研究的进展与展望 [J]. 中国药学杂志, 2010, 45(17): 1287-1294. |
| [60] | 李峻媛, 万丽, 杨美华. 真菌毒素限量标准及其在中药中的研究进展 [J]. 中草药, 2011, 42(3): 602-609. |
| [61] | 黄莉, 张浩, 丁伟琴, 等. 中药中真菌毒素污染问题 [J]. 海峡药学, 2009, 21(6): 95-99. |
 2014, Vol. 29
2014, Vol. 29



