X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein gene,XIAP)能够选择性地抑制癌细胞凋亡的上游启动分子Caspase 9和下游效应分子Caspase 3、Caspase 7,使癌细胞抵抗凋亡并对化疗产生耐药。蒽贝素又名信筒子素,是从紫金牛科植物圆齿紫金牛Myrsinaceae ardisia Virens中提取的多酚类化合物,是一种XIAP的小分子抑制剂,能与XIAP蛋白分子中BIR3结构域结合,阻止XIAP分子与Caspase 9结合而诱导细胞凋亡,增加化疗敏感性,减少肿瘤细胞耐药[1]。研究表明,XIAP表达水平与胰腺癌TNM分期、术后生存期有关[2],即XIAP表达水平高的胰腺癌组织恶性程度更高,发生血管浸润及淋巴结转移的机会更高,XIAP蛋白表达水平可作为评价胰腺癌预后的有价值指标。因Mia PaCa-2细胞在人胰腺癌系中具有代表性,且XIAP表达水平稳定,故本研究通过给予不同剂量蒽贝素处理Mia PaCa-2细胞,探讨蒽贝素对人胰腺癌增殖和凋亡的影响并分析其机制,为胰腺癌的治疗寻找毒副作用较小的药物。 1 材料与方法 1.1 药物与试剂
蒽贝素(Sigma公司提供,溶解于DMSO中,冰箱保存),二甲基亚砜(DMSO)和噻唑蓝(MTT)试剂盒购于美国Sigma公司。AnnexinV-FITC/PI凋亡检测试剂盒(货号40302ES20,规格20 rxn)购于南京凯基生物科技发展有限公司。总RNA的提取Trizol试剂盒(货号15596-026,规格100 mL)为Invitrogen公司产品,引物由生工生物工程(上海)股份有限公司提供。XIAP、Caspase 3、β-actin单抗购于美国Santa Cruz公司。ECL试剂盒购于美国Amersham Bioscience公司。人胰腺癌细胞Mia PaCa-2由美国得克萨斯州安德森癌症中心惠赠。 1.2 实验方法 1.2.1 MTT检测肿瘤细胞的增殖抑制率
Mia PaCa-2胰腺癌细胞在含10%新鲜小牛血清的RPMI 1640培养液中常规培养。制备单细胞悬液,调整细胞浓度为2×105/mL,接种于96孔板,每孔100 μL,过夜,细胞贴壁后对照组加入RPMI 1640培养液,实验组加入蒽贝素(蒽贝素终浓度分别为5、10、20 μmol/L)处理细胞48 h[3]。每组设4个复孔,每孔加入MTT 20 μL,37 ℃培养4 h。弃上清,加100 μL DMSO。用分光光度计570 nm下测定吸光度值。 1.2.2 流式细胞仪检测细胞凋亡
取细胞数约1×105个。设4组,每组3个复孔。8 h后待细胞贴壁分别加入等量RPMI 1640、蒽贝素(终浓度分别为5、10、20 μmol/L),继续抚育生长48 h后用胰酶消化离心,500 μL Binding Bufier悬浮细胞;转入EP管内;加入AnnexinV-FITC和碘化丙啶(propidium iodide,PI)各5 μL,室温避光染色30 min后上机检测。流式细胞仪检测经Single Histogram Statistic软件分析细胞凋亡率。每个浓度样本重复3次,结果以`x ± s表示。凋亡分析以右下象限早期凋亡细胞判定为凋亡细胞。 1.2.3 Western blotting免疫印迹检测
收集处理后的细胞,加入蛋白裂解液,采用ECL试剂盒进行检测。 1.2.4 RT-PCR
细胞总RNA提取按操作说明书执行。引物由生工生物工程(上海)股份有限公司合成。XIAP引物:上游:5' GAA CTG GCC AGA CTA TGC TCA 3',下游:5' AAA GTG TCG CCT GTG TTC TGA 3'。β-actin上游:5' GCA CCC AGC ACA ATG AAG ATC 3',下游:5' CTA GAA GCA TTT GCG GTG GAC 3'。PCR反应体系(20 μL):cDNA模板2 μL、上下游引物(25 mmol/L)各1 μL、QuantiTect SYBR Green PCR MIX 10 μL、ddH2O 6 μL,95 ℃、10 min,95 ℃、20 s,57 ℃、20 s,40个循环。计算对照组XIAP表达量相对于实验组的变化[4]。

CT值指PCR扩增过程中,扩增产物的荧光信号达到设定阈值时所经过的扩增循环次数 1.2.5 统计学处理
统计分析由软件包SPSS 15.0完成,计量数据以`x ± s表示,各组间比较采用t检验,每组内不同处理方式比较采用方差分析。 2 结果 2.1 蒽贝素对Mia PaCa-2细胞增殖抑制作用
MTT结果显示,5、10、20 μmol/L蒽贝素对Mia PaCa-2细胞增殖活性均有抑制作用,且随着时间和剂量的增加,细胞存活率明显降低。见表 1。 2.2 流式细胞仪检测细胞凋亡
流式细胞仪分析结果显示,与对照组比较,肿瘤细胞凋亡率随药物浓度增加而明显增高,各实验组与对照组比较差异有统计学意义(P<0.01),提示蒽贝素可诱导Mia PaCa-2细胞发生凋亡,并呈明显的剂量相关性,结果见图 1和表 2。 2.3 RT-PCR检测结果
与对照组比较,各实验组经不同剂量蒽贝素作用24~48 h后Mia PaCa-2细胞中XIAPmRNA表达均减低(P<0.05)。表明经蒽贝素处理后的胰腺癌细胞中的表达量低于对照组,在对照组Mia PaCa-2细胞中XIAPmRNA表达的−△△CT值约为实验组的11.31倍,结果见表 3。
| 表 1 蒽贝素对胰腺癌细胞Mia PaCa-2细胞增殖的影响(`x ± s,n=4) Table.1 Effects of embelin on proliferationof pancreatic Mia PaCa-2 cells (`x ± s,n=4) |
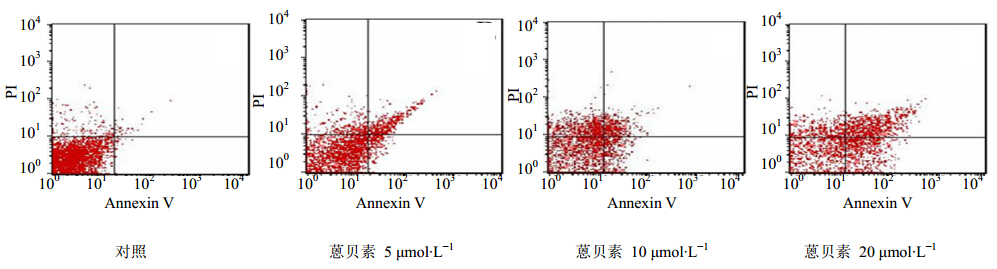 | 图 1 蒽贝素24 h对人胰腺癌Mia PaCa-2细胞凋亡率的影响Fig.1Effects of embelin on apoptosis rates of pancreatic Mia PaCa-2 cells during 24 h |
| 表 2 不同剂量蒽贝素处理24 h时对Mia PaCa-2细胞生长和凋亡的影响(`x ± s,n=4) Table. 2 Effects of embelin at different doses on growth and apoptosis of pancreatic Mia PaCa-2 cells treated for 24 h(`x ± s,n=4) |
Western blot显示Mia PaCa-2细胞的XIAP蛋白表达在20 μmol/L蒽贝素处理24 h后明显下调,在48 h以后尤为显著;此外,蒽贝素对cleaved Caspase 3蛋白有上调作用,与对照组比较差异具有统计学意义(P<0.05),结果见表 4和图 2。
另外,促凋亡蛋白Bax的表达逐渐增强,而抗凋亡蛋白Bcl-2表达逐渐减弱,与对照组比较差异
| 表 3 相同剂量蒽贝素处理细胞24、48 h后对Mia PaCa-2 XIAP mRNA表达的影响(`x ± s,n=3) Table. 3 Effects of embelin insame dose on expression of XIAP mRNA of pancreatic Mia PaCa-2 cells treated for 24 and 48 h (`x ± s,n=3) |
具有统计学意义(P<0.05),结果见表 5和图 3。各组随着浓度增加和时间推移蒽贝素的作用呈增强趋势。 3 讨论
XIAP在大多数肿瘤细胞株中过表达,其表达与肿瘤的进展、复发、预后以及肿瘤化疗耐药密切相关[5]。在人类凋亡抑制基因家族8个成员中因BIRC4(XlAP)对caspases凋亡途径的明显抑制作用而成为IAPs(inhibitor of apoptosis proteins)家族
| 表 4 蒽贝素处理24 h和48 h对Mia PaCa-2细胞XIAP和Caspase 3裂解片段蛋白表达的影响(`x ± s,n=3) Table. 4 Effects of embelin on protein expression levels of XIAP and cleaved Caspase 3 of pancreatic Mia PaCa-2 cells treated for 24 and 48 h (`x ± s,n=3) |
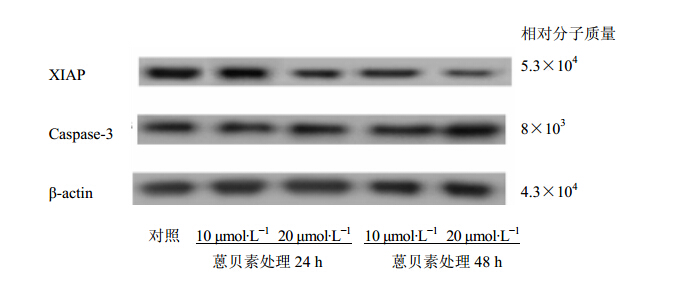 | 图 2 蒽贝素处理24 h和48 h对Mia PaCa-2细胞XIAP和Caspase 3裂解片段蛋白表达的影响 Fig. 2 Effects of embelin on protein expression levels of XIAP and cleaved Caspase 3 of pancreatic Mia PaCa-2 cells treated for 24 and 48 h |
| 表 5 蒽贝素处理24 h和48 h对Mia PaCa-2细胞Bax/Bcl-2表达的影响(`x ± s,n=4) Table. 5 Effects of embelin on expression levels of apoptotic gene of Bax/Bcl-2 of pancreatic Mia PaCa-2 cells at 24 h and 48 h (`x ± s,n=4) |
中的研究热点和目前抗凋亡治疗中最有潜力的治疗靶点。实验结果表明XIAP mRNA在Mia PaCa-2细胞中表达,这为进一步选择XIAP为胰腺癌治疗靶点奠定了理论基础。
蒽贝素是从植物圆齿紫金牛M. ardisia Virens中提取的具有抗肿瘤、抗炎、抗生育活性的化合物[6],可通过与XIAP蛋白BIR3功能域的结合阻止XIAP抑制caspase的活性。研究表明[7,8],通过阻止XIAP与Caspase 9结合,蒽贝素在低剂量就可以直接诱导多种肿瘤细胞凋亡,具备化学合成类靶向抗肿瘤药物的基本特征。在本研究中,MTT结果表明,蒽贝素可抑制Mia PaCa-2细胞的增殖并表现为一定的剂量相关性,在一定范围内随着剂量增加,对胰腺癌细胞增殖的抑制作用越来越明显。流式细胞仪分析结果发现,与对照组细胞相比,蒽贝素可明显诱导肿瘤细胞发生凋亡,并且随着药物剂量增加细胞凋亡率也越来越高,证明蒽贝素有促进胰腺癌细胞凋亡作用。Western blotting分析显示,蒽贝素作用Mia PaCa-2细胞24 h后,XIAP蛋白表达明显下降,表明作为XIAP小分子抑制剂的蒽贝素是通过降低XIAP的表达诱导胰腺癌细胞的凋亡。
为研究蒽贝素参与促进Mia PaCa-2细胞凋亡
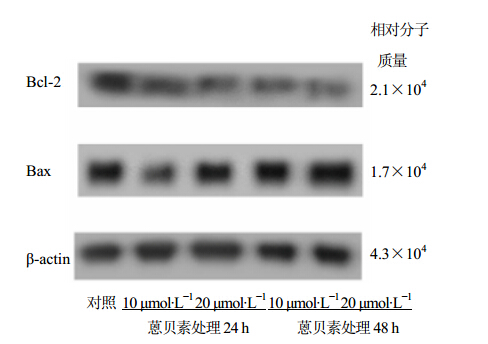 | 图 3 蒽贝素处理24 h和48 h对Mia PaCa-2细胞Bax/Bcl-2表达的影响Fig. 3 Effects of embelin on gene expression levels of Bax/Bcl-2 of pancreatic Mia PaCa-2 cells treated for 24 and 48 h |
的机制,本实验进一步检测了凋亡下游通路相关蛋白的表达。发现伴随胰腺癌细胞中XIAP的表达降低,导致Mia PaCa-2细胞中Caspase 3活性的显著提高,且表现为随蒽贝素剂量增加和时间延长,Caspase 3裂解片段表达明显增加,与文献报道的XIAP作用机制相符[9]。Caspase 3是细胞凋亡的执行者,其活化在细胞凋亡信号中起核心作用,激活后可特异性地切割PARP,达到阻止已损伤DNA修复的目的[10]。本实验的RT-PCR结果也证实经蒽贝素处理后的胰腺癌细胞中XIAP的表达量小于对照组,进一步支持蒽贝素是通过抑制XIAP的表达激活caspases级联凋亡途径诱导的胰腺癌细胞凋亡。
细胞发生凋亡的机制十分复杂,受到严格的基因调控。bcl-2是公认的凋亡调控基因,bax是bcl-2基因家族成员之一,bax和bcl-2通过形成同源或异源二聚体来调节细胞凋亡。研究表明[11],miRNA-21通过直接上调Bcl-2表达,下调Bax的表达阻止胰腺癌Mia PaCa-2细胞凋亡,增强对吉西他滨的耐药性并促进肿瘤细胞增殖。为进一步探究蒽贝素对胰腺癌细胞凋亡的影响是否存在其他途径,本实验同时对Mia PaCa-2细胞Bax/Bcl-2凋亡蛋白进行检测,结果发现蒽贝素可上调促凋亡蛋白Bax,下调抗凋亡蛋白Bcl-2的表达,说明蒽贝素可能还通过上调Bax和下调Bcl-2调节细胞线粒体的通透性,从而影响下游促凋亡基因的功能而诱导细胞发生凋亡。
本研究结果显示,在细胞水平上蒽贝素抑制人胰腺癌Mia PaCa-2细胞增殖,明显诱导细胞凋亡,主要通过激活半胱氨酸蛋白酶(caspases)级联反应。由于细胞水平与人体实体肿瘤在细胞生长、分化及迁移有一定差别,尚不能完全模拟肿瘤的真正生长环境与转移特性,故有必要进一步从动物体内研究蒽贝素对胰腺癌的影响,故本研究结果为进一步体内研究蒽贝素的抗肿瘤效果提供实验依据。
| [1] | Lin Y F, Lai T C, Chang C K, et al. Targeting the XIAP/caspase-7 complex selectively kills caspase-3-deficient malignancies[J]. J Clin Invest, 2013, 123(9): 3861-3875. |
| [2] | 孙建建, 李胜棉, 赵松, 等. 胰腺癌组织XIAP蛋白表达预后价值的探讨[J]. 中华肿瘤防治杂志, 2011, 18(19): 1537-1540. |
| [3] | 朱秀丽, 江莲, 陈健, 等. XIAP抑制剂Embelin对人T淋巴瘤细胞Jurkat增殖抑制作用[J]. 中国肿瘤临床, 2012, 39(22): 1757-1760. |
| [4] | Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45. |
| [5] | Stadel D, Mohr A, Ref C, et al. TRAIL-induced apoptosis is preferentially mediated via TRAIL receptor 1 in pancreatic carcinoma cells and profoundly enhanced by XIAP inhibitors[J]. Clin Cancer Res, 2010, 16(23): 5734- 5749. |
| [6] | 曾宪彪, 韦宝伟, 韦桂宁, 等. 蒽贝素对雄性大鼠血浆性激素水平及附睾精子质量的影响[J]. 药物评价研究, 2013, 36(6): 414-417. |
| [7] | Li Y, Li D, Yuan S, et al. Embelin-induced MCF-7 breast cancer cell apoptosis and blockade of MCF-7 cells in the G2/M phase via the mitochondrial pathway[J]. Oncol Lett, 2013, 5: 1005-1009. |
| [8] | 田红, 贺星, 徐颂, 等. 化学合成类靶向抗肿瘤药物的研究进展[J]. 现代药物与临床, 2009, 24(1): 8-14. |
| [9] | 郑丽端, 童强松, 汪良, 等. 下调XIAP表达增强化疗药物诱导胃癌细胞凋亡的作用[J]. 世界华人消化杂志, 2007, 15(29): 3067-3073. |
| [10] | Irshad S, Ashworth A, Tutt A. Therapeutic potential of PARP inhibitors for metastatic breast cancer[J]. Expert Rev Anticancer Ther, 2011, 11(8): 1243-1251. |
| [11] | Dong J, Zhao Y P, Zhou L, et al. Bcl-2 upregulation induced by miR-21 via a direct interaction is associated with apoptosis and chemoresistance in MIA PaCa-2 pancreatic cancer cells[J]. Arch Med Res, 2011, 42(1): 8-14. |
 2014, Vol. 29
2014, Vol. 29

