2. 沈阳药科大学, 辽宁 沈阳 110016
2. Shenyang Pharmaceutical University, Shenyang 110016, China
普瑞巴林是抑制性神经递质γ-氨基丁酸(GABA)的结构类似物,由Warner-Lambert公司开发,2004年12月在美国FDA批准上市,随后2004年7月在欧盟批准上市,用于治疗成年患者的部分癫痫发作[1]。2006年3月增加适应症,治疗广泛性焦虑障碍和社交性焦虑障碍,2009年又获准治疗脊髓损伤、外伤、多发性硬化症、糖尿病性神经疼痛和带状疱疹神经疼痛[2,3,4]。3-异丁基戊二酰亚胺为常用的化工中间体,是普瑞巴林的主要起始原料,文献报道的合成方法是以3-异丁基戊二酸为原料在IV价的硝酸铈铵存在下,与甲醇酯化[5]、在氢氧化钠水溶液中水解[6]、酰胺化[6]、甲苯做溶剂,哌啶碱催化环合[7]得到目标产物。本实验采用“一勺烩”的方法设计了简便的合成工艺,以异戊醛为原料,经Knoevenagel缩合、Michael加成、水解脱羧、环合得到3-异丁基戊二酰亚胺,经过1H-NMR、MS等方法确证了结构。 1 仪器与试剂
YRT—3熔点仪(天津大学精密仪器厂);Waters Quattro Premier XE质谱仪(美国Waters公司);Bruker ARX—400 MHz核磁共振仪(德国Bruker公司);Thermo Scientific Nicolet iS5型傅里叶变换红外光谱仪(美国Nicolet公司);PLSB型低温冷却液循环泵、低温恒温反应浴(巩义市予华仪器有限责任公司);RE52AA旋转蒸发仪(上海亚荣生化仪器厂);ZF—20D暗箱式紫外分析仪(上海顾村电光仪器厂);Agilent 1260高效液相色谱仪、G1314B VL泵(美国安捷伦公司);SHZ—D(III)循环水式多用真空泵。
所用试剂均为市售分析纯。 2 方法与结果 2.1 合成路线
将异戊醛(7.31 g,85 mmol)、氰醋酸乙酯(8.74 g,77.3 mmol)、甲苯100 mL加入250 mL三口瓶中,搅拌下,缓慢加入正二丙胺0.08 g,滴毕,升温至回流,分水器回流分水,当无水产生时,停止反应,浓缩甲苯,减压蒸干,得黄色液体1。
向黄色液体1中加入丙二酸二乙酯(14.80 g,92.5 mmol),冰浴冷却下,缓慢加入正二丙胺(0.8 g,7.8 mmol),控温0 ℃以下,加完后,室温搅拌2 h。加入1 mol/L盐酸42 mL,回流1 h。然后加入甲苯50 mL,分出有机层,水层用甲苯(50 mL×2)萃取。合并有机层,浓缩甲苯得到棕黄色油状物2。
将上述棕黄色油状物2(7.8 g,13.08 mmol)和脲(0.8 g,13.08 mmol)加入100 mL三口瓶中,油浴加热至90~110 ℃,搅拌反应2 h,冷却至室温,加入50%乙醇水溶液,回流30 min,冷却,滤过,50 ℃真空干燥,得到类白色片状结晶3-异丁基戊二酰亚胺(10.2 g,78.0%)。
3-异丁基戊二酰亚胺的合成路线见图 1。
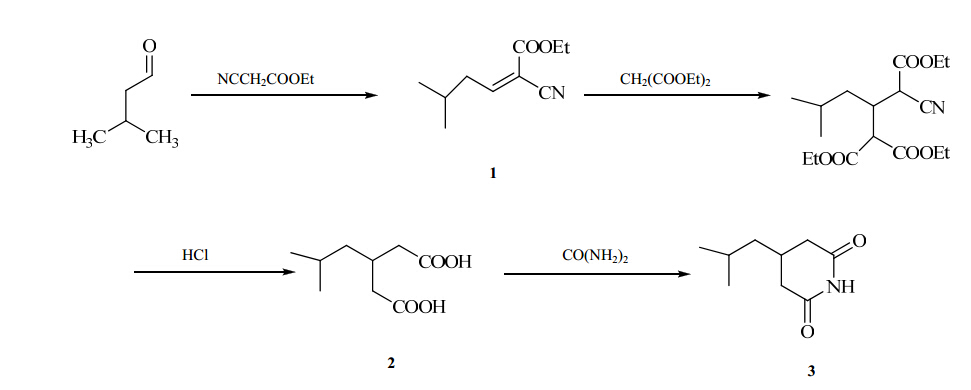 | 图 1 高精度烧结零件Fig.1Synthetic route of 3-isobutyl glutarimide |
色谱条件:Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μL);流动相为0.01 mol/L磷酸溶液-乙腈(60∶40);体积流量为1 mL/min;检测波长为214 nm;柱温为30 ℃;进样量为10 μL。
在上述色谱条件下,采用面积归一化法测得目标化合物的质量分数为98.5%。mp 137~138 ℃。ESI-MS m/z:126.0,128.0。1H-NMR(400 MHz,CDCl3)δ:8.07(1H,br,CONHCO),2.65~2.73(4H,m,CH2-3、5),1.63~1.70(1H,m,CH-3′),1.24~1.27(2H,m,CH2-2′),0.91(6H,d,CH3-4′)。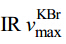 (cm−1):3 192,3 186,3 092,3 085,2 959,2 954,1 805,1 798,1 686,1 682,1 423,1 384,1 366,1 290,1 268。与文献报道[8]数据基本一致,鉴定目标化合物为3-异丁基戊二酰亚胺。
3 讨论
(cm−1):3 192,3 186,3 092,3 085,2 959,2 954,1 805,1 798,1 686,1 682,1 423,1 384,1 366,1 290,1 268。与文献报道[8]数据基本一致,鉴定目标化合物为3-异丁基戊二酰亚胺。
3 讨论
参考相关文献,选择脲与异丁基戊二酸进行环合反应,避免了原文献氢氧化钠水解羧酸甲酯易产生双水解副反应[6],可以有效提高合成收率,同时提高产品的质量。
本研究所采用“一勺烩”的方法,与文献报道的其他合成路线相比,合成中间体无需进行后处理可直接用于下步反应,大大缩短了反应时间,简化了操作步骤,从而降低成本。
本研究的合成方法所用的试剂都价廉易得,且毒性较小,实验条件也易于控制,操作简便,适用于工业化大生产。
| [1] | Freeman R, Durso-Decruz E, Emir B. Efficacy, safety, and tolerability of pregabalin treatment for painful diabetic peripheral neuropathy: findings from seven randomized, controlled trials across a range of doses[J]. Diabetes Care, 2008, 31(7): 1448. |
| [2] | Gray P. Pregabalin in the management of central neuropathic pain[J]. Expert Opin Pharmaco, 2007, 8(17): 3035-3041. |
| [3] | Ryvlin P, Perucca E, Rheims S. Pregabalin for the management of partial epilepsy[J]. Neuropsychiatr Dis Treat, 2008, 4(6): 1211-1224. |
| [4] | 陈永升, 李勋, 程若男, 等. 普瑞巴林的合成研究进展[J]. 有机化学, 2011, 31(10): 1582-1594. |
| [5] | Jung J H, Yoon D H, Kang P, et al. CAL-B catalyzed desymmetrization of 3-alkylglutarate: ""olefin effect"" and asymmetric synthesis of pregabalin[J]. Org Biomol Chem, 2013, 11(22): 3635-3641. |
| [6] | Sterimbaum G, Hedvati L, Raizi Y, et al. Stereoselective enzymatic synthesis of (S) or (R)-isobutyl-glutaric ester[P]. WO: 2009158343, 2009-12-30. |
| [7] | Bhatt N, Trivedi A Y, Gandhi D, et al. Novel process for racemization of an optically active (S)-3-carbamoyl- methyl- 5-methyl-hexanoic acid to corresponding 3- carbamoylmethyl- 5-methyl-hexanoic acid racemate[P]. WO: 2013076630, 2013-05-30.Anil B C, Golak C M, Mukund K G. An efficient process of racemization of 3-(carbamoylmethyl)-5-methylhexanoic acid: a pregabalin intermediate[J]. Org Process Res Dev, 2009, 13(4): 812-814. |
| [8] | Anil B C, Golak C M, Mukund K G. An efficient process of racemization of 3-(carbamoylmethyl)-5-methylhexanoicacid: a pregabalin intermediate [J]. Org Process Res Dev, 2009, 13(4): 812-814. |
 2014, Vol. 29
2014, Vol. 29

