2. 天津药物研究院, 天津 300193;
3. 中药制药共性技术国家重点实验室, 山东 临沂 276006
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. State Key Laboratory of Generic Pharmaceutical Technology for Chinese Medicine, Linyi 276006, China
高乌甲素又名拉巴乌头碱,是从毛茛科植物高乌头Aconitum sinomontanum Nakai根中提取的一种二萜类生物碱,其结构见图 1。高乌头又名穿心莲乌头,为毛茛科乌头属植物,其性温,味苦辛,具有祛风除湿、理气止痛、活血消肿等功效,主要用于风湿痹痛、关节肿痛、胃痛、跌打损伤等[1]。高乌甲素作为高乌头镇痛的有效成分,为我国首创的非成瘾性镇痛药,药理研究已证明其具有较强的镇痛[2]、抗炎[3]、局麻[4]及抗心律失常作用[5],对癌症疼痛及其他顽固性疼痛效果尤为显著。临床上常使用高乌甲素的氢溴酸盐,用于中度以上疼痛的治疗。
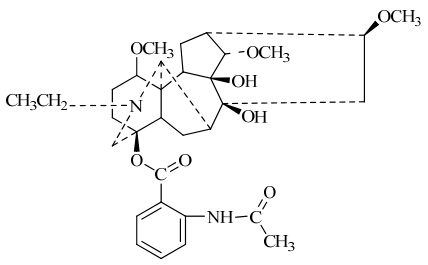 | 图 1 高乌甲素的结构Fig. 1 Structure of lappaconitine |
高乌甲素作为止痛常用药,常用剂型有片剂、注射剂、注射粉针剂等,随着研究的深入及临床反馈,其常用制剂的弊端逐渐显现。由其化学结构可看出,高乌甲素母核为四环二萜,致使其在水中的溶解度极低,其氢溴酸盐在水中亦是微溶,这就会导致普通片剂口服后药物溶出慢或不能完全溶出,生物利用度较低。静脉注射虽然生物利用度高,但静脉注射在体内消除半衰期短,有研究发现小鼠以不同剂量iv高乌甲素后,半衰期仅为0.48 h,平均滞留时间(MRT)为0.25 h[6],这又会导致给药次数增加,患者顺应性降低。此外,稳定性问题也是限制其临床应用的一大因素,刘秀花等[7]在考察氢溴酸高乌甲素原料药的稳定性后发现,强光照射10 d后其量下降约5%,提示氢溴酸高乌甲素对光较为敏感。而其分子中的酯基及酰胺基在水溶液中易水解和氧化,粉针剂的出现虽然在一定程度上解决了此问题,但仍有文献报道显示氢溴酸高乌甲素冻干粉在强光照射条件下不稳定[8],这就增加了临床用药的不安全因素。由此可见,其溶解度和稳定性问题的存在限制了高乌甲素常用制剂的广泛应用,影响了临床疗效,使得新型制剂的研究成为临床用药的迫切需求。
为克服上述缺点,科研工作者进行了高乌甲素不同新型制剂的研发以满足不同的治疗目的,主要有载体制剂、缓控释制剂、速释制剂等,得到的新型制剂能够提高药物的生物利用度、降低不良反应、提高患者顺应性,为其临床广泛应用奠定了基础。
1 载体制剂载体制剂是将药物包封于不同载体分子中形成的载药微粒。药物被包裹后可增加溶解度,加快溶出速度,提高生物利用度,并使药物治疗具有靶向性。为了达到以上目的,包合技术、纳米粒技术被逐渐应用于高乌甲素的制剂研究中。
1.1 环糊精包合物环糊精包合技术近年来已在制剂中广泛应用。药物被环糊精包合后,不仅能增加溶解度,提高溶出度和生物利用度,还能减少药物的刺激性和不良反应等[9, 10]。张涛等[11]和马君义等[12]分别研究了β-环糊精和羟丙基-β-环糊精对氢溴酸高乌甲素和高乌甲素的包合作用,二者在其试验条件下均可形成主客分子比为1∶1的包合物,通过比较包合前后溶出度的变化发现,包合后溶出度均明显增大,且改变包合条件的pH值会导致溶出度的变化。王兰霞等[13]还就β-环糊精及其衍生物对高乌甲素增溶作用的差异进行了研究,通过比较β-环糊精、羟丙基-β-环糊精和葡萄糖基-β-环糊精发现,三者对高乌甲素均具有增溶作用,但衍生物的增溶作用明显强于β-环糊精母体。以上研究显示,环糊精包合对高乌甲素具有增溶能力,在包合过程中选择环糊精衍生物且适当调节条件的pH值可增大其增溶能力,如羟丙基-β-环糊精在弱碱性条件下包合其增溶能力就较大。
1.2 纳米粒纳米粒是由粒径为1~1 000 nm的粒子组成的体系。纳米粒具有提高药物水溶性、延长药物在体内滞留时间及改变药物在体内的分布等特性,因而成为近些年胶体载药体系中的研究热点[14]。王兰霞等[15]进行了氢溴酸高乌甲素壳聚糖纳米粒(LH- CHI-NP)的制备工艺研究,采用离子交联法,药物与壳聚糖的质量比为3∶4,所制得LH-CHI-NP载药量为26.4%,包封率为35.6%,平均粒径为500 nm。该研究中所制得的LH-CHI-NP包封率不是很高,可能是由于该实验选择了脱乙酰度较高的壳聚糖,这种壳聚糖制得的纳米粒骨架紧密,但是药物不易被包被,导致包封率偏低。陈桐楷等[16]采用高压乳匀法制备了氢溴酸高乌甲素固体脂质纳米粒(LH-SLN),以生理相容性好的单硬脂酸甘油酯为骨架载体材料,优化工艺条件后制得的LH-SLN包封率达到70.48%,体外释药结果显示LH-SLN的释药特点为开始快速释药,后期缓慢释药。林华庆等[17]采用同样的方法制备了LH-SLN,所制得的纳米粒平均粒径为26.6 nm,包封率为51.6%,体外释药结果显示前10 h释药速率较快,随后缓慢释放,经72 h药物累积释放率约92%。纳米粒的释药特性为高乌甲素药效尤其是镇痛作用的发挥创造了有利条件,能够降低高乌甲素在体内的清除率,延长半衰期,提高相对生物利用度,但这些还需要进一步的体内药动学研究进行验证。此外,药剂工作者还可考虑发挥纳米粒的可修饰性,使高乌甲素的纳米粒可被疼痛部位特异性识别,靶向聚集于疼痛病灶,发挥镇痛疗效,减小副作用,提高药效。
2 缓控释制剂目前市售的氢溴酸高乌甲素注射液采用静脉滴注或1~2次/d im给药,片剂口服1~3片/d,患者通常是感觉到疼痛后才给药,这种按需给药而非按时给药的方式使疼痛不能得到有效的控制,而且会导致血药浓度波动范围大,患者依从性差,达不到预期的治疗目的。缓控释制剂能使体内保持平稳有效的血药浓度,提高血药浓度的谷峰比值,延长药物作用时间,减少给药次数,提高患者顺应性。
2.1 口服缓控释制剂廖维等[18]发明了一种高乌甲素缓释制剂组合物的制备方法,所用缓释基质选自羟丙甲纤维素(HPMC)、乙基纤维素(EC)或甲基纤维素(MC),3种缓释材料所得制剂在12~24 h都能起到缓释作用,释放度结果均匀,缓释基质优选为HPMC。钟海军等[19]使用HPMC作为缓释材料制备的氢溴酸高乌甲素缓释片可12 h持续释放药物。高源等[20]以HPMC为亲水性凝胶骨架材料进行了氢溴酸高乌甲素亲水凝胶骨架片的制备及处方优化研究,所制备的缓释片无突释现象,缓释周期12 h,药物释放达到90%,根据拟合方程,药物释放符合一级释放模型,其释放既有扩散,又有骨架溶蚀。综上所述,HPMC作为较理想的缓释材料,对药物的释放有明显的影响。而其用量也与药物的释放速率紧密相关,HPMC用量增加时,药物的扩散和骨架的溶蚀速度均减慢,从而使药物释放速率减慢。
此外,强音等[21]针对高乌甲素的抗心律失常作用进行了氢溴酸高乌甲素脉冲释放片的研究,以非水溶性的乙基纤维素和肠溶性的丙烯酸树脂为包衣材料制备的脉冲释放片能够保证药物在pH值<6的酸性环境下不释放,在pH值>6时延迟释放,从而减小了药物对胃的刺激作用。随着衣膜厚度增加,脉冲释放片中药物释放的时间也将延长,因此,通过改变片芯处方以及衣层的组成和厚度,可以得到在体外有不同释放时滞的片剂,为药物的定时释放和结肠靶向制剂的研究提供一些参考。
2.2 透皮制剂高乌甲素的化学结构显示其具有较适宜的油水分配系数,具备一定的经皮渗透性,因此可将其制成透皮制剂。透皮制剂具有针对疾病部位定点给药,可避免肝脏的首关效应,延长药物作用时间,减少给药次数,降低毒副作用,使用方便等特点,在治疗风湿、类风湿性关节炎等疾病上具有一定优势,目前已有高乌甲素贴片上市。现已申请专利的高乌甲素贴片[22]和氢溴酸高乌甲素贴片[23]均采用药物和压敏胶,再加入适量透皮促进剂制成。压敏胶起着控释的作用,常用的有丙烯酸酯、聚异丁烯和聚硅氧烷,透皮促进剂能够增加药物的渗透性,常用有氮酮、丙二醇、油酸等等。
微乳和凝胶作为透皮给药制剂的新型载体,是近年来药剂学研究的热点。李西林等[24, 25]以油酸和Miglyol 812作为微乳体系的油相,Cremopher EL和Transcutol P分别作为表面活性剂和助表面活性剂研制出了高乌甲素微乳,所制得的微乳外观透明,其载药量、粒径及渗透系数分别为5.21 g/L、16.6 nm、12.74 cm/h,具有良好的透皮能力。陈桐楷[26]首次将LH-SLN作为经皮给药载体制成了透皮凝胶剂,由于SLN粒径很小,凝胶中的水分蒸发后,SLN粒子相互粘连,在皮肤表面形成一层封闭的膜,从而增加角质层的水合作用,提高药物的穿透力。高建青等[27]研制了一种氢溴酸高乌甲素透皮凝胶剂,以水性凝胶剂卡波姆为优选基质材料,同时加入了透皮促进剂和三乙醇胺,通过三乙醇胺调节pH值来增加卡波姆的黏度和稠度,该凝胶剂具有水溶性,经皮给药皮肤吸收良好,透皮速率高达4.96 μg/(cm2·h),可满足治疗需要。在以上制剂研究的基础上,邱永锋等[28]将氢溴酸高乌甲素微乳和凝胶制剂的镇痛效果进行了比较,发现微乳镇痛效果优于凝胶。分析其原因可能是因为皮肤角质层由脂质双分子层组成,具有天然的屏障作用,是药物透皮吸收的限速因素,微乳中的油酸可通过分解角质层类脂的紧密结构来降低皮肤的阻力,并增加角质层类脂层状区域固-液相的分离来提高皮肤的通透性。
此外,肖春雷等[29]和王晓青等[30]还分别进行了氢溴酸高乌甲素鼻用原位凝胶和混悬凝胶剂的制备。由于鼻黏膜下具有丰富的毛细血管,药物能够被迅速吸收进入体循环,鼻腔与脑部还存在着某种联系,药物经鼻吸收后可绕过血脑屏障直接进入脑脊液或脑组织发挥药效,因此经鼻给药为中枢性疾病的治疗提供了一条有效的给药途径。文献中原位凝胶采用结冷胶为凝胶基质,混悬凝胶采用Avicel® RC/Cl为基质,二者给药后均能黏附于鼻黏膜表面,延长药物在鼻腔的滞留时间,增加药物在鼻黏膜的吸收,提高生物利用度。药物从凝胶基质中的释放具有缓释特点,释放出的药物通过鼻黏膜能够快速起效,且具有脑靶向作用,但是高乌甲素的不良反应也曾有报道,直接的脑靶向给药会不会对脑产生毒副作用还值得进一步的研究。
2.3 缓释微球注射剂缓释微球(microspheres)是药物分散或被吸附在高分子材料基质中形成的固体颗粒分散体,直径一般在1~300 μm,属于基质型骨架微粒,注射用微球采用生物可降解高分子材料制成,常用的骨架材料有聚乳酸-羟基乙酸共聚物(PLGA)、聚乳酸(PLA)、聚羟基乙酸(PGA)等。徐荷林[31]进行了高乌甲素注射用生物可降解缓释微球的研究,采用乳化-溶剂挥发法成功将高乌甲素包裹在PLGA微球中,所制备微球粒径(19.3±0.93)μm,包封率为(70.77±3.23)%,载药量为(11.45±0.47)%。体外释放试验结果显示该微球在体外能够持续释放20 d左右,具有明显的缓释作用,释放机制为药物的扩散以及PLGA基质的溶蚀共同作用。将高乌甲素包裹在微球中不仅可提高其光稳定性,载药微球以固态粉末保存还可防止水解。高乌甲素注射用缓释微球的出现极大的改善了普通注射剂体内消除快、给药次数多、药物稳定性差等问题,因此具有良好的应用前景。
3 速释制剂高乌甲素和氢溴酸高乌甲素的低水溶性导致其普通片剂溶出慢,起效也慢,不能满足患者迅速止痛的要求。注射剂起效虽快,但是不便携带和使用。为了达到迅速止痛的目的和效果,制剂工作者们研发出了一系列的高乌甲素速释制剂并且取得了良好的效果。
3.1 分散片分散片是近几年发展起来的一种口服速释剂型,能够在水中迅速崩解并且分散均匀。它结合了片剂和液体制剂的优点,具有服用方便,且溶出、吸收较普通片剂快,生物利用度较高的特点。关长安[32]采用湿法制粒压片法制备了氢溴酸高乌甲素分散片,所得分散片可在1 min内完全崩解并形成均匀的混悬液,45 min时药物溶出度大于90%。胡雪莲等[33]采用同样的方法制备了氢溴酸高乌甲素分散片。所得分散片,外观光洁,在25 s内能完全崩解,并通过内径为710 μm的筛,10 min内溶出度达80%以上。强音等[34]选择直接用干法压片来制备分散片,选择乳糖和甘露醇为混合填充剂,所得片在15 s内即可完全崩解,10 min内药物可溶出完全,分散速度较普通片剂明显加快。由于分散片剂型的特殊性,对崩解的要求较高,崩解剂的种类及用量会直接影响分散片的崩解和溶出效果。对常用的崩解剂低取代羟丙基纤维素(L-HPC)、交联聚维酮(PVPP)、羧甲基淀粉钠(CMS-Na)进行考察后发现,PVPP崩解时限最短,最适用于该分散片的制备。而干法压片即粉末直接压片法,工艺简单、生产周期短、不必使用有机溶剂且成本较低,适合于工业化大生产。
3.2 口崩片口崩片,即口腔崩解片,是一种不需水即能在口腔内快速崩解或溶解的新型片剂,具有携带使用方便、患者依从性高、起效快等优点,特别适合于老人、儿童、吞咽困难或饮水不便的患者。目前,国内外关于氢溴酸高乌甲素口腔崩解片的报道并不多见。张恩娟等[35]首次制备了氢溴酸高乌甲素口腔崩解片,根据其处方中是否含有胃溶性丙烯酸树脂可分为两种类型:一种仅采用添加矫味剂的方法来掩盖原药的苦味,另一种是将原料药与胃溶性丙烯酸树脂混合制成掩味颗粒,再采用压片法将颗粒制成口崩片。由于胃溶性丙烯酸树脂在pH值>5的口腔中不溶解,药物在口腔中的释放受到阻滞,达到掩味的效果,崩解后的颗粒随唾液入胃,胃溶性丙烯酸树脂在pH值<5的胃液中迅速溶解,释放药物从而快速起效。将二者比较发现,两种口崩片在口腔中1 min内均能迅速崩解,但不含胃溶性丙烯酸树脂的口崩片制备工艺更简单,药物溶出更快,而含胃溶性丙烯酸树脂的口崩片相对掩味效果较好。氢溴酸高乌甲素味苦且有麻舌感,因此,口感问题是其口崩片研制中的技术难题。若口感不良,患者顺应性差;若将原料药进行包合或微囊化,又会影响药物的溶出。如何使口崩片既具有良好的口感又不影响药物的释放是亟待研究的一个问题。
3.3 速释滴丸曲韵智等[36]制备了氢溴酸高乌甲素滴丸,利用表面活性剂为基质,与氢溴酸高乌甲素制成固体分散剂,使药物呈分子、胶体或微晶状态分散于基质中。滴丸中基质为亲水性,与唾液接触即迅速溶化,使药物能迅速溶散成微粒或溶液,由口腔黏膜和舌下毛细血管吸收,不仅起效快,还可避免肝脏的首关效应,提高生物利用度。但目前尚未见其体外溶出考察及体内药动学研究的相关报道。
4 讨论高乌甲素作为一种应用前景广泛的镇痛药,虽已有贴片上市,但目前最常用的剂型仍为普通片剂、注射剂、注射粉针剂。普通片剂口服吸收慢,生物利用度低,注射剂和粉针剂使用不方便,且消除半衰期短,需频繁给药,患者顺应性差。因此,利用现代化药物制剂研究的新思路和新技术对高乌甲素传统制剂进行剂型改造,使高乌甲素选择性的到达靶器官,在必要的时间内维持有效的血药浓度,从而提高生物利用度、增强药物疗效、减少不良反应,是其深入研究的重点和难点。缓控释与速释制剂近年来研究较多,也已有多种高乌甲素新剂型申报了专利,但目前上市的只有高乌甲素贴片,绝大部分都处于前期研究阶段,很多剂型只进行了制备工艺研究,未见其体内药效学及药动学报道,这就需要药学工作者更进一步的探索研究,加快高乌甲素剂型改造的步伐,扩大其临床应用。
| [1] | 国家中医药管理局. 中华本草[M]. 第3册. 上海: 上海科学技术出版社, 1999: 144-145. |
| [2] | Ou S, Zhao Y D, Xiao Z, et al. Effect of lappaconitine on neuropathic pain mediated by P2X3 receptor in rat dorsal root ganglion[J]. Neurochem Int, 2011, 58(5): 564-573. |
| [3] | Wang Y Z, Xiao Y Q, Zhang C, et al. Study of analgesic and anti-inflammatory effects of lappaconitine gelata[J]. J Tradit Chin Med, 2009, 29(2): 141-145. |
| [4] | 林密迦, 杨锡馨. 高乌甲素对手术致痛大鼠的镇痛及局麻作用的研究[J]. 海峡药学, 2011, 23(4): 29-31. |
| [5] | Vakhitova IuV, Farafontova E I, Khisamutdinova RIu, et al. To the mechanisms of antiarrhythmic action of allapinine[J]. Bioorg Khim, 2013, 39(1): 105-116. |
| [6] | 李子敬. 氢溴酸高乌甲素药物代谢及动力学研究[D]. 大连: 大连理工大学. 2010. |
| [7] | 刘秀花, 史彦斌, 管玉珠. 氢溴酸高乌甲素原料药的稳定性研究[J]. 中国药业, 2009, 18(8): 21-22. |
| [8] | 刘勐, 史彦斌, 管玉珠. 氢溴酸高乌甲素注射液及冻干粉的稳定性[J]. 中国医院药学杂志, 2010, 30(2): 111-113. |
| [9] | 恽菲, 徐晓琰, 狄留庆, 等. 蛇床子素不同环糊精包合物的制备及其生物利用度比较研究[J]. 中草药, 2014, 45(3): 341-348. |
| [10] | 夏海建, 张振海, 蒋俊, 等. 雷公藤红素环糊精与油自组装小珠载药系统的制备及其体外评价[J]. 中草药, 2013, 44(19): 2672-2676. |
| [11] | 张涛, 袁才英, 杨金风. 氢溴酸高乌甲素β-环糊精包合物的研究[J]. 中国药师, 2001, 4(5): 331-332. |
| [12] | 马君义, 张继, 李佳佳, 等. 羟丙基-β-环糊精对高乌甲素的包合作用及其热力学稳定性[J]. 西北师范大学学报, 2012, 48(4): 66-70. |
| [13] | 王兰霞, 李士博. β-环糊精及其衍生物对高乌甲素增溶作用的研究[J]. 中国药事, 2010, 24(8): 756-758. |
| [14] | 陈孝储, 郭一沙, 严子平, 等. 新型纳米粒载体在药物或基因传递中的应用[J]. 中国药学杂志, 2013, 48(21): 1797-1803. |
| [15] | 王兰霞, 李士博, 张晓明. 氢溴酸高乌甲素壳聚糖纳米粒的制备工艺研究[C]. 西北地区第五届色谱学术报告会暨甘肃省第十届色谱年会论文集. 西宁: 西北地区第五届色谱学术报告会暨甘肃省第十届色谱年会, 2008: 343-349. |
| [16] | 陈桐楷, 李园, 林华庆, 等. 高压乳匀法制备氢溴酸高乌甲素固体脂质纳米粒的工艺研究[J]. 中国药学杂志, 2010, 45(6): 440-443. |
| [17] | 林华庆, 张蜀, 邓红, 等. 一种氢溴酸高乌甲素固体脂质纳米粒及其制备方法[P]. 中国: 101658495, 2010-03-03. |
| [18] | 廖维, 朱少璇, 王健松, 等. 一种高乌甲素缓释制剂组合物及其制备方法[P]. 中国: 103315979A, 2013-09-25. |
| [19] | 钟海军, 高源. 氢溴酸高乌甲素缓释片及其制备方法[P]. 中国: 102885812A, 2013-01-23. |
| [20] | 高源, 李凤英, 刘玲, 等. 氢溴酸高乌甲素亲水凝胶骨架片的制备及体外释放[J]. 中国现代应用药学, 2013, 30(7): 740-744. |
| [21] | 强音, 倪京满. 氢溴酸高乌甲素脉冲释放片的研究[J]. 中国新药杂志, 2008, 17(9): 760-763. |
| [22] | 刘海龙, 高虹, 黄玉兰, 等. 一种高乌甲素透皮贴片及其制备方法[P]. 中国: 101574331, 2009-11-11. |
| [23] | 高建青, 钟韵伟, 吴争, 等. 一种氢溴酸高乌甲素透皮贴片及其制备方法[P]. 中国: 101062019, 2007-10-31. |
| [24] | 李西林, 栾晶, 王慧, 等. 高乌甲素微乳的研制与评价[J]. 上海中医药大学学报, 2012, 26(3): 98-101. |
| [25] | 李西林, 栾晶, 王慧, 等. 高乌甲素微乳体外透皮吸收[J]. 中国实验方剂学杂志, 2012, 18(10): 52-54. |
| [26] | 陈桐楷. 氢溴酸高乌甲素固体脂质纳米粒作为经皮给药载体的研究[D]. 广州: 广东药学院, 2010. |
| [27] | 高建青, 钟韵伟, 吴争, 等. 一种氢溴酸高乌甲素透皮凝胶剂及其制备方法[P]. 中国: 101062034, 2007-10-31. |
| [28] | 邱永锋, 沙先谊, 方晓玲. 两种氢溴酸高乌甲素经皮给药制剂药效学研究[J]. 中国民族民间医药, 2012(6): 38-39. |
| [29] | 肖春雷, 朱家壁, 孙超. 氢溴酸高乌甲素鼻用原位凝胶剂的制备及其处方评价[J]. 药学进展, 2009, 33(9): 416-419. |
| [30] | 王晓青, 张洪洲, 高磊, 等. 氢溴酸高乌甲素鼻用混悬凝胶的制备与评价[J]. 解放军药学学报, 2012, 28(6): 477-480. |
| [31] | 徐荷林. 高乌甲素注射用生物可降解缓释微球的研究[D]. 南昌: 南昌大学, 2011. |
| [32] | 关长安. 氢溴酸高乌甲素分散片及其制备方法[P]. 中国: 1850077, 2006-10-25. |
| [33] | 胡雪莲, 雷健, 邢茂, 等. 氢溴酸高乌甲素分散片的处方优化及制备[J]. 中国医院药学杂志, 2012, 32(8): 613-616. |
| [34] | 强音, 倪京满. 氢溴酸高乌甲素分散片的制备及体外溶出特性研究[J]. 时珍国医国药, 2008, 19(5): 1197-1199. |
| [35] | 张恩娟, 胡雪莲, 邢茂, 等. 氢溴酸高乌甲素口腔崩解片及其制备方法[P]. 中国: 102178658A, 2011-09-14. |
| [36] | 曲韵智, 徐俊福. 氢溴酸高乌甲素滴丸及其制备方法[P]. 中国: 1686120, 2005-10-26. |
 2014, Vol. 29
2014, Vol. 29


