2. 石药集团 中诺药业(石家庄)有限公司, 河北 石家庄 050000;
3. 石药集团 恩必普药业有限公司, 河北 石家庄 050000
2. Shijiazhuang Pharma Group Zhongnuo Pharmaceutical (Shijiazhuang) Co., Ltd., Shijiazhuang 050000, China;
3. Shijiazhuang Pharma Group NBP Pharmaceutical Co., Ltd., Shijiazhuang 050000, China
瑞舒伐他汀钙片是一种降血脂类固体口服制剂,在胃肠道中必须首先在胃肠液中溶出才能被吸收并到达体循环,药物在体内的释放和吸收直接影响其药效。溶出度试验是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验法,是评价和控制药品制剂质量的一个重要指标。因此,研究瑞舒伐他汀钙片的体外溶出行为意义重大。目前已有瑞舒伐他汀钙片溶出度测定的报道,但方法不尽相同[1, 2, 3, 4]。本实验对本公司连续生产的3种规格、9批成品和原研制剂进行了溶出度试验,制定了具体可行的溶出方法,结果证明所制定方法科学、合理、准确度高。
1 仪器与试药UV—1601紫外-可见分光光度计(日本岛津);ZRS—6智能溶出试验仪(天津大学无线电厂);XA205型电子分析天平(梅特勒-托利多公司)。
瑞舒伐他汀钙片(商品名可定),规格10 mg,批号GB458,阿斯利康制药有限公司。瑞舒伐他汀钙对照品,批号090701,质量分数99.7%,石药集团中奇制药技术(石家庄)有限公司。瑞舒伐他汀钙原料,批号090901,质量分数99.1%,石药集团中奇制药技术(石家庄)有限公司。瑞舒伐他汀钙片,规格5 mg,批号090901、090902、090903;规格:10 mg,批号090904、090905、090906;规格20 mg,批号090907、090908、090909,石药集团中诺药业(石家庄)有限公司。
微晶纤维素(规格25 kg/袋,批号090405,安徽山河药用辅料有限公司);乳糖(规格25 kg/袋,批号090509,邢台精晶药业有限公司);交联聚维酮(规格25 kg/袋,批号03800194663,美国国际特品公司);硬脂酸镁(规格10 kg/袋,批号20090204,辽宁奥达制药有限公司);胃溶型包衣粉(规格20 kg/箱,批号090412,天津爱勒易医药材料有限公司);甲醇为分析纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果 2.1 溶出度的紫外-可见分光光度法测定 2.1.1 测定波长的选择按处方比例称取空白辅料、包衣粉、瑞舒伐他汀钙对照品适量(约相当于瑞舒伐他汀25 mg)分别置3个25 mL量瓶中,加入50%甲醇适量,超声使溶解,并加水至刻度,摇匀。分别取上述溶液1 mL置100 mL量瓶中,分别用水、0.1 mol/l盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液稀释,并加至刻度,摇匀。在200~400 nm波长扫描,结果显示,不同介质中瑞舒伐他汀钙的最大吸收波长均在241 nm左右,且片芯辅料与包衣粉在该波长下无吸收。所以测定波长选定为241 nm。
2.1.2 溶液稳定性试验取2.1.1项下溶液,分别在0、1、2、4、8 h考察241 nm波长下的吸光度。结果表明,瑞舒伐他汀在水和磷酸盐介质中8 h内基本稳定。在0.1 mol/L HCl和pH 4.5醋酸盐缓冲液中2 h内稳定,能够满足溶出曲线研究的需要。
2.1.3 线性关系考察取瑞舒伐他汀钙对照品适量(约相当于瑞舒伐他汀25 mg),精密称定,置100 mL棕色量瓶中,加入50%甲醇溶液适量,超声使溶解,加水稀释成0.25 mg/mL溶液,分别取0.5、1.0、1.5、2.0、2.5、3.0 mL溶液于50 mL棕色量瓶中,用水稀释,并加至刻度,在241 nm波长处测定吸光度。以吸光度值对质量浓度做图,得线性方程Y=0.034 6 X+0.002,r=0.999 9,表明瑞舒伐他汀钙在2.62~15.72 μg/mL线性关系良好。
2.1.4 系统精密度试验取批号090904瑞舒伐他汀钙片样品,采用桨板法,以水900 mL为溶出介质,转速50 r/min,30 min后,取其中一杯溶液适量,滤过,取续滤液,经适当稀释,使成为含瑞舒伐他汀约10 μg/mL溶液,作为供试品溶液。取瑞舒伐他汀钙对照品适量(约相当于瑞舒伐他汀25 mg),精密称定,置25 mL量瓶中,加50%甲醇溶液溶解,并稀释至刻度,摇匀,精密量取1 mL,置100 mL量瓶中,加水稀释至刻度,作为对照品溶液。取上述两种溶液,照紫外-可见分光光度法在241 nm波长处分别测定吸光度。供试品溶液重复测定6次,计算溶出量,结果溶出量的RSD值为 0.51%。
2.1.5 方法精密度试验按照2.1.4项下方法,取批号090904瑞舒伐他汀钙片样品平行6份,制备供试品溶液;同上法制备对照品溶液。照紫外-可见分光光度法在241 nm波长处分别测定其吸光度值。计算每份的溶出量,结果6份供试品溶液的溶出量的RSD值为0.78%。
2.1.6 回收率试验精密称取瑞舒伐他汀钙原料适量(约相当于瑞舒伐他汀25 mg),置于100 mL棕色量瓶中,照处方比例称取辅料,加入棕色量瓶中,加50%甲醇溶液10 mL,超声使主药溶解,加水稀释至刻度,摇匀,滤过。精密量取续滤液1、2、3 mL各3份于50 mL棕色量瓶中,加水稀释至刻度,摇匀,在241 nm波长处测定吸光度。另精密称取瑞舒伐他汀钙对照品适量,制成含瑞舒伐他汀10 μg/mL的对照品溶液,同法测定。计算得平均回收率为100.5%,RSD值为0.7%。
2.2 桨板法测定溶出度的研究[5] 2.2.1 溶出介质体积的选择选择规格10、20 mg的样品,采用900 mL溶出介质,吸光度值恰好在最佳范围内。选择规格5 mg的样品,采用900 mL溶出介质时,全部溶出时吸光度为0.3左右。而未完全溶出时,吸光度小于0.3,造成测定不准确。当采用500 mL溶出介质,完全溶出时吸光度值在0.42左右,比较合适,且满足漏槽条件,故规格5 mg的样品拟采用500 mL溶出介质。
2.2.2 转速的选择选择水为溶出介质,采用75、50 r/min进行试验,考察3个规格批号091201、091204、091207样品的溶出曲线情况。结果表明3个规格样品在75、50 r/min的转速下,在15 min内都能够达到85%以上的溶出量,且溶出均一性都很好,基于桨板法50 r/min转试验条件温和,故选择50 r/min作为转速的控制条件。
2.2.3 不同介质中供试品与被仿品溶出行为的比较和溶出介质的选择为了更好地考察本品质量,分别在水、0.1 mol/L盐酸、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液中与被仿品可定的体外溶出行为进行了比较,溶出介质的配制参照《中国药典》2010年版方法[6]。实验仅以10 mg规格的供试品与被仿品作溶出行为的对比研究。
分别取本品(批号091204,规格10 mg)和被仿品可定(批号GB458),采用桨板法,分别以水、0.1 mol/l盐酸、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液900 mL为溶出介质,转速50 r/min,分别于5 、10、15、20、30、45 min取溶液5 mL(每次取样后立即补充相同温度的溶出介质5 mL),滤过,弃去初滤液,以续滤液作为供试品溶液。另取瑞舒伐他汀钙对照品适量(约相当于瑞舒伐他汀25 mg),精密称定,置25 mL量瓶中,加50%甲醇溶液溶解并稀释至刻度,摇匀,精密量取1 mL,置100 mL量瓶中,加溶出介质稀释至刻度,作为对照品溶液。取上述两种溶液,在241 nm波长处分别测定吸光度值,计算每片的累积溶出量,结果见图 1。结果表明,供试品与被仿品的体外溶出行为相似,4种不同溶出介质中,供试品与被仿品15 min累积溶出量均能达到85%以上,水体系比较简单,因此首选水作为供试品测定用溶出介质。
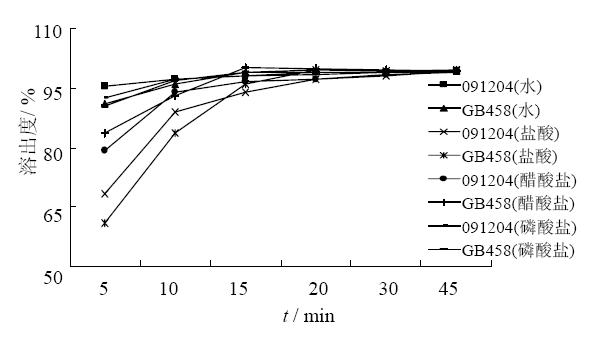 | 图 1 不同介质中供试品与被仿品溶出行为的比较Fig. 1 Comparison ondissolution behaviors of sample and imitated product in different media |
考察3个规格9批样品的批内溶出均一性和批间重现性,批内溶出均一性测定9批样品以水为溶出介质时的溶出曲线,见表 1~3。批间重现性中,3批之间的5、10、15、20、30、45 min的平均累积溶出量的RSD值5 mg规格样品的分别为1.4%、0.9%、1.2%、0.8%、0.4%、1.0%;10 mg规格样品的分别为1.8%、0.3%、0.6%、0.7%、0.8%、0.6%;20 mg规格样品的分别为0.8%、0.3%、0.2%、0.5%、0.4%、0.3%。结果表明各规格供试品批内溶出均一性和批间溶出均一性均良好。
| 表 1 5 mg规格供试品批内溶出均一性结果 Table 1 Dissolution uniformity of within-batches of 5 mg samples |
| 表 2 10 mg规格供试品批内溶出均一性结果 Table 2 Dissolution uniformity of within-batches of 10 mg samples |
| 表 3 20 mg规格供试品批内溶出均一性结果 Table 3 Dissolution uniformity of within-batches of 20 mg samples |
取本品,采用桨板法,以水500 mL(规格5 mg)或900 mL(规格10、20 mg)为溶出介质,转速50 r/min,30 min后,取溶液适量,滤过,取续滤液,经适当稀释,使成含瑞舒伐他汀约10 μg/mL的溶液,作为供试品溶液。另取瑞舒伐他汀钙对照品适量(约相当于瑞舒伐他汀25 mg),精密称定,置25 mL量瓶中,加50%甲醇溶液溶解并稀释至刻度,摇匀,精密量取1 mL,置100 mL量瓶中,加水稀释至刻度,作为对照品溶液。取上述两种溶液,照紫外-可见分光光度法在241 nm波长处分别测定吸光度值,计算每片的溶出量。供试品与被仿品的溶出度对比结果见图 2。可见样品均能够在30 min溶出完全,体外溶出行为相似。
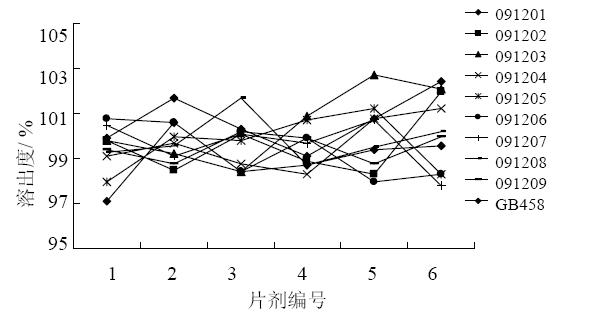 | 图 2 供试品与被仿品溶出度的测定结果Fig. 2 Measurement results of sample and imitated product |
参照已有文献,依据实制样品和被仿品的溶出度试验,本实验优化并制定了合理的溶出方法,以保准确、快速、有效地测定瑞舒伐他汀钙片的溶出度。《印度药典》2010年版[1]采用桨板法,以pH 6.8磷酸盐900 mL为溶出介质,转速50 r/min,30 min后取样,在248 nm波长处HPLC法测定;孙俊[2]采用转篮法,以水1 000 mL为溶出介质,转速100 r/min,30 min后取样,在241 nm波长处紫外-可见分光光度法测定;魏碧风[3]采用桨板法,以水1 000 mL为溶出介质,转速75 r/min,45 min后取样,在248 nm波长处HPLC法测定;Patel等[4]采用反相高效液相色谱法研究瑞舒伐他汀钙片和替米沙坦复合制剂的溶出行为。由于本品对光不太稳定,实验过程中需及时测定。采用HPLC法不适合瑞舒伐他汀钙片溶出曲线的测定研究。与HPLC法相比,紫外-可见分光光度法既能准确测定瑞舒伐他汀钙片的溶出度,又能简化操作、快速分析、减少费用,故本实验首选紫外-可见分光光度法;孙俊[2]和魏碧风[3]方法中的转速过高,溶出条件均过于宽松。
相关文献均未提及规格5 mg样品的溶出度研究,在瑞舒伐他汀钙片的溶出度试验中,本法对5 mg规格样品作了深入研究。溶出介质体积为900 mL时,其吸光度值偏小,不在最佳测定范围内。而采用小杯法时,吸光度值偏大,超出最佳测定范围而引起检测误差,故未采用小杯法。当采用500 mL溶出介质,完全溶出时吸光度在0.4左右,比较合适,且满足漏槽条件,故将500 mL作为规格5 mg样品溶出介质体积。
3种不同规格(5、10、20 mg)样品均采用相同处方比例制片。10 mg规格供试品在溶出介质水、0.1 mol/L盐酸、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液中均与被仿品体外溶出行为相似,推测5 mg和20 mg规格的供试品与被仿品的体外溶出行为相似。后期的生物等效性试验也证实了上述推断,故本实验采用的瑞舒伐他汀钙片供试品与被仿品具有一致的安全性和有效性。供试品与被仿品体外溶出行为的一致性和供试品批内溶出与批间溶出的良好均一性证明了本法的可行性。连续9批供试品与被仿制品的溶出度检测结果表明本法精密度高,重现性好。
| [1] | 印度药典[S]. 2010: 2072. |
| [2] | 孙俊. 瑞舒伐他汀钙片的含量及溶出度测定[J]. 中国药业, 2010, 19(3): 30-31. |
| [3] | 魏碧风. HPLC测定瑞舒伐他汀钙片的含量及溶出度[J]. 海峡药学, 2012, 24(10): 88-90. |
| [4] | Patel B, Sheth A, Doshi N, et al. Comparative in vitro dissolution study of rosuvastatin calcium and telmisartan by RP-HPLC[J]. J Chem Pharm Res, 2010, 2(3): 237-243. |
| [5] | 中国药典[S]. 二部. 2010: 附录86.中国药典[S]. 二部. 2010: 附录176-177. |
 2014, Vol. 29
2014, Vol. 29


