2. 沈阳药科大学 生命科学与生物制药学院, 辽宁 沈阳 110016
2. School of Life Science and Biopharmaceuticals, Shenyang Pharmaceutical University, Shenyang 110016, China
厚朴为木兰科厚朴Magnolia officinalis Rehd. et Wils.和凹叶厚朴M. officinalis Rehd. et Wils. subsp. biloba (Rehd. et Wils.) Law的干皮、枝皮和根皮,具有行气燥湿、降逆止吐等作用[1]。厚朴酚与和厚朴酚为厚朴的主要活性成分,也是该药材和相关制剂质量控制的重要依据和标准[2]。随着临床上对于厚朴酚与和厚朴酚需求量的增加,能够在有限的资源里获取高收率和高纯度的厚朴酚与和厚朴酚已是迫在眉睫的问题。目前文献报道[3, 4, 5, 6]厚朴总酚的提取纯化方法多为醇提取、萃取、酸处理、重结晶或超临界流体萃取法等。这些方法中萃取、酸处理、重结晶的方法操作繁琐、实验周期长、纯度有限。而超临界流体萃取法对仪器设备要求高、产物杂质多、需进一步后处理。基于此,本课题组想寻找一种操作简单、速度快、效率高的制备高纯度厚朴总酚的方法。
近年来闪式硅胶柱色谱的应用较为广泛,其与常压柱色谱法相比明显缩短了样品在硅胶柱中的时间,可以减少死吸附,缩短实验周期。本课题组曾利用闪式硅胶柱色谱法制备了环阿尔廷型三萜皂苷类化合物[7, 8],王长云等[9]利用加压硅胶柱色谱法制备了二十碳四烯酸衍生物。本文探讨了应用闪式硅胶色谱法从厚朴总提物中直接制备质量分数大于99.5%的厚朴总酚的方法,此方法与传统方法相比仪器设备要求低、操作简单、耗时短、纯度高。同时,此方法制备得到的厚朴总酚中厚朴酚与和厚朴酚的质量分数易于控制,可以满足不同实验目的的需求。
1 仪器与材料 1.1 仪器LC3000高效液相色谱仪(北京创新通恒科技有限公司);BSA124S电子天平(德国Sartorius公司);玻璃柱(457 mm×32 mm,北京欣维尔玻璃仪器有限公司,批号20131024072)。
1.2 试药95%医用酒精、石油醚、环己烷、丙酮、醋酸乙酯、氢氧化钠、盐酸、柱色谱硅胶(200~300目)等均为分析纯,购自山东禹王实业有限公司;甲醇为色谱纯(山东禹王实业有限公司);厚朴酚、和厚朴酚对照品(中国食品药品检定研究院,批号MUST-12122406)。
1.3 药材来源厚朴饮片,产地为江西,购自沈阳天益堂大药房,经沈阳药科大学药用植物教研室路金才教授鉴定为厚朴Magnolia officinalisRehd. et Wils.的干皮。
2 方法与结果 2.1 厚朴总酚的测定[10] 2.1.1 色谱条件Agilent C18色谱柱(250 mm×4.6 mm,5 μm);流动相甲醇-水(78∶22),柱温为35 ℃,进样量为20 μL,检测波长292 nm。
2.1.2 对照品溶液的制备精密称取厚朴酚、和厚朴酚对照品各4 mg,置10 mL量瓶中,加入适量甲醇溶解并稀释至刻度,制成质量浓度均为0.4 mg/mL厚朴酚、和厚朴酚对照品溶液。
2.1.3 供试品溶液的制备分别精密称取待测样品2 mg,分别置100 mL量瓶中,加入适量甲醇溶解并稀释至刻度,摇匀,即得。
2.1.4 线性关系考察精密移取混合对照品溶液0.025、0.25、0.5、1、1.5、2、2.5 mL,置10 mL量瓶中,用甲醇稀释至刻度,摇匀,得质量浓度分别为1、10、20、40、60、80、100 μg/mL系列溶液,分别进样20 μL。以质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得回归方程。和厚朴酚:Y=642 X-30 723,r=0.999 8,线性范围1~100 μg/mL;厚朴酚:Y=535 X-1 378.7,r=0.999 9,线性范围1~100 μg/mL。
2.1.5 样品测定分别精密量取溶液20 μL,注入液相色谱仪,记录色谱图,见图 1。厚朴酚、和厚朴酚的tR值分别为9.585、6.483 min。质量分数计算采用面积归一化法。总厚朴酚的质量分数的结果根据两个成分的面积归一化加和。
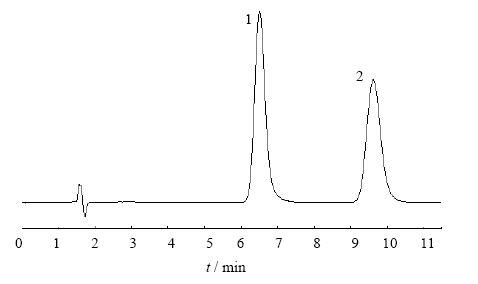 |
1-和厚朴酚 2-厚朴酚 1-honokiol 2-magnolol 图 1 厚朴酚、和厚朴酚对照品的HPLC图谱Fig. 1 HPLC chromatograms of magnolol andhonokiol reference substances |
综合对比文献中报道[3, 4]的厚朴醇提法的工艺,选择收率最高的提取工艺,即将厚朴药材粉碎成中粉,选择用60%乙醇回流提取3次,加入溶剂量分别是5、4、5倍,提取时间分别是2、1.5、1 h,温度控制在60 ℃。
在醇提取的基础上,进一步探讨了应用闪式硅胶柱色谱对厚朴总酚进行分离纯化的方法,从样品前处理方法、硅胶用量、洗脱溶剂、体积流量4个方面进行了考察和条件优化。
2.3 样品前处理方法的选择分别考察了醇提取物直接进行闪式硅胶柱色谱分离以及醇提物的石油醚萃取物进行闪式硅胶柱色谱两种方法。
各取100 g厚朴中粉药材,分别用上述方法进行提取,一份提取液浓缩后得厚朴醇提取物20 g,另一份提取物浓缩至100 mL,用等体积石油醚萃取5次,合并萃取液,挥干称得石油醚萃取物134 mg。二者分别取相同量浸膏(相当于10 g生药材)经硅胶柱色谱纯化,两种方法所得厚朴总酚的质量分数差异不显著(提取物直接上样和经石油醚萃取后上样所得厚朴总酚质量分数分别为98.51%、98.92%),而浸膏直接进行闪式硅胶柱色谱法所得总厚朴酚的收率为经石油醚萃取后再进行闪式硅胶柱色谱法的2倍,且缩短了实验周期,节约了实验成本,因此选择醇提取物直接经闪式硅胶柱色谱纯化为最佳样品的前处理方式。
2.4 硅胶用量的选择分别考察了100 mg醇提物样品应用5、8、10、12倍量硅胶拌样,拌样后的硅胶直接装入玻璃柱色谱柱中,进行梯度洗脱。从表 1可以看出随着硅胶用量增加,厚朴总酚的分离度提高,收率降低。综合考虑质量分数、收率、成本和实验周期的因素,得出硅胶用量为样品量10倍时厚朴总酚的质量分数和收率为最佳值。
| 表 1 不同硅胶用量所得厚朴总酚的质量分数和收率 Table 1 Content and yield of total phenols with different amounts of silica gel |
通过薄层色谱分析预示,可知石油醚-醋酸乙酯和石油醚-丙酮两个溶剂体系均具有较好的分离效果。实验对这两种混合溶剂体系分别进行考察,各取100 mg厚朴醇提物,用10倍量硅胶进行硅胶柱色谱分离纯化,分别以石油醚-醋酸乙酯(10∶1~10∶3)和石油醚-丙酮(10∶1~10∶3)梯度洗脱。经薄层色谱和HPLC分析,以石油醚-醋酸乙酯为洗脱溶剂时,(10∶2)、(10∶3)洗脱流份中含有厚朴酚与和厚朴酚的质量分数和收率见表 2。以石油醚-丙酮为洗脱溶剂时,(10∶2)洗脱流份中主要含有厚朴酚,而(10∶3)洗脱流份中主要含有和厚朴酚,质量分数和收率见表 2。
| 表 2 不同洗脱溶剂所得厚朴总酚的质量分数和收率 Table 2 Content and yield of total phenol with different mobile phases |
由于市售的厚朴总酚中和厚朴酚与厚朴酚的质量分数不一致,研究中发现不同的洗脱体系对二者的质量分数影响甚大,因此本研究采用和厚朴酚与厚朴酚的比值可以为不同实验目的的科研工作者提供参考和依据。
结果表明在硅胶闪式色谱法制备厚朴总酚的过程中,可以根据最终需要的不同,选择不同阶段的产品,从而得到厚朴酚与和厚朴酚质量分数不同的厚朴总酚产物。
经HPLC分析结果表明石油醚-醋酸乙酯洗脱体系所得产品收率远远高于石油醚-丙酮洗脱体系,而丙酮的市售价是醋酸乙酯的2倍,且质量分数更高,结合成本价和收率考虑,石油醚-醋酸乙酯是最佳溶剂体系。
2.6 体积流量的选择分别考察了闪式硅胶柱色谱常用的5种体积流量(3、5、6、7、8 mL/min)。低体积流量(3、5 mL/min)洗脱时,色带明显,分离度好,总厚朴酚的质量分数较高;高体积流量(6、7、8 mL/min)洗脱时,色带交叉,分离度降低,见表 3。综合考虑实验周期、分离度等因素,应该选择5 mL/min为最佳洗脱体积流量。
| 表 3 不同体积流量所得厚朴总酚的质量分数和收率 Table 3 Content and yield of total phenols with different flow rates |
综上可知,初步确定最佳工艺为:厚朴60%乙醇提取物,用10倍量的硅胶拌样装柱进行闪式色谱分离,以石油醚-醋酸乙酯(10∶1~10∶3)作为梯度洗脱溶剂,体积流量选择5 mL/min。为了进一步考察此工艺的稳定性和可靠性,考察了样品量放大后此工艺所得产品的质量分数和收率,见表 4。可见厚朴醇取物用量增加后,依此工艺所得厚朴总酚产品的质量分数均大于99.5%,收率大于0.6%,说明此工艺稳定可行。
| 表 4 不同上样量所得厚朴总酚的质量分数和收率 Table 4 Content and yield of total phenols with different sampling amounts |
本文探讨了利用闪式硅胶柱色谱法从厚朴总提物中快速制备高纯度厚朴总酚的方法可行性,并优化了主要参数,确定最佳工艺如下:选用厚朴乙醇60%提取物,用10倍量的硅胶进行拌样装柱,以石油醚-醋酸乙酯(10∶1~10∶3)作为梯度洗脱溶剂,体积流量选择5 mL/min。
综合所得实验结果,与传统的厚朴总酚纯化制备工艺相比,本方法有产品质量分数高、操作简单、实验周期短的优点。文献中报道的传统纯化工艺所得厚朴总酚质量分数最高为98%,而本工艺所得产品质量分数>99.5%。传统工艺制备厚朴总酚需经过萃取、酸处理、重结晶等操作步骤,本工艺中直接应用厚朴总提取物进行闪式硅胶柱色谱,应用石油醚-醋酸乙酯快速洗脱,简化了操作步骤,且石油醚和醋酸乙酯均为易挥发有机溶剂,不易在产品中残留。传统工艺中萃取溶剂浓缩、酸碱处理所需时间较长,以100 g药材量计,一个制备周期需要42 h,而本工艺中应用的硅胶闪式色谱法中,采用空白硅胶直接拌样后进行色谱分离的方法,简化操作省略了空白硅胶装柱的步骤,随后应用指定溶剂系统快速洗脱,大大缩短了实验周期,100 g药材1次制备周期约需要22 h。本工艺比传统工艺的制备周期缩短了一半的时间且在放大实验中具有稳定可行性。
本工艺的不足之处在于需要进一步的工业化放大试验,从而能大幅度增加样品制备量。由于本工艺可以快速得到高纯度的总厚朴酚,缩短了实验周期,降低了成本,能满足市场对高纯度厚朴总酚的需求。因此进一步的工业化放大后具有很大的开发潜力和良好的应用前景。
| [1] | 中国药典[S]. 一部. 2010: 176. |
| [2] | 龚建明, 林勇. 厚朴的现代研究与进展[J]. 东南国防医药, 2008, 10(2): 125-126. |
| [3] | 张宝堂. 98%纯度厚朴酚、和厚朴酚工业生产工艺研究[D]. 长沙: 湖南中医药大学, 2008. |
| [4] | 李棣华. 厚朴正交提取工艺的初步研究[J]. 天津中医药, 2005, 22(1): 68-70. |
| [5] | 周俊伟. 正交试验法优选厚朴酚提取工艺[J]. 陕西中医学院学报, 2006, 29(6): 59-60. |
| [6] | 李卫民, 牛志强, 王治平, 等. 超声强化超临界提取厚朴酚与和厚朴酚的工艺研究[J].中草药, 2011, 42(4): 680-683. |
| [7] | 李宁, 李铣, 孟大利, 等. 环阿尔廷型三萜皂苷类化合物、制备方法及其应用[P]. 中国: 101824068A, 2010-09-08. |
| [8] | 李宁, 李铣, 李占林, 等. 玉蕊醇型三萜皂苷类化合物、制备方法及其应用[P]. 中国: 101824067A, 2010-09-08. |
| [9] | 王长云, 邵长伦, 牟海津, 等. 一种二十碳四烯酸衍生物及其制备方法与应用[P]. 中国: 101417949, 2009-04-29. |
| [10] | 龙晓蕾, 陈曦, 刘高, 等. 快速测定厚朴中厚朴酚及其含量的方法[J]. 现代生物医学进展, 2009, 9(8): 1523-1525. |
 2014, Vol. 29
2014, Vol. 29


