清眩软胶囊是由川芎、白芷、荆芥穗、薄荷、石膏5味中药组成,具有散风清热之功效,用于风热头晕目眩,偏正头痛、鼻塞。清眩软胶囊是清眩片的改剂型品种,充分保留该药中的挥发性成分,并减少服用量,便于患者服用[1]。组方中白芷、川芎为君药,荆芥穗、薄荷为方中臣药;故本实验通过采用高效液相色谱(HPLC)法测定有效成分欧前胡素来控制质量,同时采用薄层色谱(TLC)法对川芎、荆芥穗和薄荷3味药材进行了鉴别,从而有效控制清眩软胶囊的质量。
1 仪器和试药岛津LC—20AD 高效液相色谱仪,SPD—20A紫外检测器(日本岛津公司);CP225D电子天平(德国赛多利斯);XMTD数显水浴锅(余姚市东方电工仪器厂);KQ—500DE型数控超声波清洗器(昆山市超声仪器有限公司)。
薄层色谱用高效硅胶G板(烟台市化学工业研究所);乙腈、甲醇为色谱纯,水为去离子水,其他试剂均为分析纯。川芎对照药材(批号120918- 201110)、荆芥穗对照药材(批号121424-201002)、薄荷素油对照品(批号111551-200702)、欧前胡素规格为0.45 g/粒)、缺川芎的阴性样品、缺荆芥穗的阴性样品、缺薄荷的阴性样品、缺白芷的阴性样品均为天津中新药业集团股份有限公司达仁堂制药厂自制。
2 方法与结果 2.1 川芎的薄层色谱法鉴别取清眩软胶囊50粒,剪开,倾出内容物,置挥发油提取器中,加水200 mL,按照《中国药典》2010年版一部附录挥发油测定法提取挥发油30 min,放出提取器中水液,弃去;挥发油中加入醋酸乙酯2 mL,溶解,作为供试品溶液。另取除川芎外按处方配比制成的阴性样品21 g, 同法制成阴性样品溶液。再取川芎对照药材2 g,加无水乙醇15 mL,超声处理30 min,滤过,滤液作为对照药材溶液。按照《中国药典》2010年版一部TLC法试验,吸取上述3种溶液各2 μL,分别点于同一高效硅胶G薄层板上,以正已烷-醋酸乙酯(15∶1)为展开剂[2],展开,取出,晾干,置紫外灯(365 nm)下检视。结果供试品色谱中在与川芎对照药材色谱相应的位置显相同颜色的荧光斑点,阴性样品色谱在相应位置无干扰,见图 1。
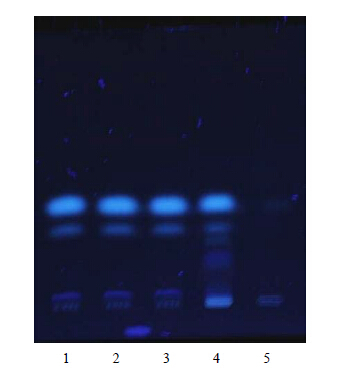 | 1~3-清眩软胶囊 4-川芎对照药材 5-阴性样品 1—3-Qingxuan Soft Capsule 4-Chuanxiong Rhizoma reference raw material 5- negative sample图 1 清眩软胶囊中川芎的薄层色谱图Fig. 1 TLC Chromatogram of Chuanxiong Rhizoma in Qingxuan Soft Capsule |
取“2.1”项下的醋酸乙酯液,作为供试品溶液。另取除荆芥穗外按处方配比制成的阴性样品22.5 g,按“2.1”项下的醋酸乙酯液的制备方法制成阴性样品溶液。再取荆芥穗对照药材3 g,置烧瓶中,加水200 mL,照挥发油测定法(附录XD)提取挥发油2 h,自挥发油提取器上端加入醋酸乙酯1 mL,溶解,分取醋酸乙酯液,制成荆芥穗对照药材溶液。按照《中国药典》2010年版一部TLC法试验,吸取供试品溶液、阴性样品溶液各2 μL,荆芥穗对照药材溶液10~15 μL,分别点于同一高效硅胶G薄层板上,以正已烷-醋酸乙酯(15∶1)为展开剂[2],展开,取出,晾干,喷以香草醛硫酸试液,在105 ℃加热至斑点显色清晰。结果供试品色谱中在与荆芥穗对照药材色谱相应的位置显相同颜色的斑点,阴性样品色谱在相应位置无干扰,见图 2。
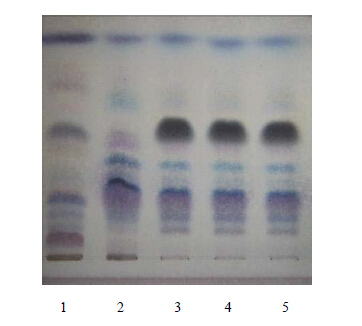 | 1-荆芥穗对照药材 2-阴性样品 3~5-清眩软胶囊 1-Schizonepetae Spica reference raw material 2-negative sample 3—5-Qingxuan Soft Capsule图 2 清眩软胶囊中荆芥穗的TLC色谱图Fig. 2 TLC Chromatogram of Schizonepetae Spica in Qingxuan Soft Capsule |
2.3 薄荷的薄层色谱法鉴别
取“2.1”项下的醋酸乙酯液,作为供试品溶液。另取除薄荷外按处方配比制成的阴性样品22.5 g,按“2.1”项下的醋酸乙酯液的制备方法制成阴性样品溶液。取薄荷素油对照品1 mL置100 mL量瓶中,加无水乙醇至刻度,混匀,制成薄荷素油对照品溶液。按照《中国药典》2010年版一部TLC法试验,吸取上述3种溶液各5~10 μL,分别点于同一高效硅胶G薄层板上,以正已烷-醋酸乙酯(15∶1)为展开剂[2],展开,取出,晾干,在薄层板上喷以香草醛硫酸试液,在105 ℃加热至斑点显色清晰。结果供试品色谱中在与薄荷素油对照品色谱相应的位置显相同颜色的主斑点,阴性样品色谱在相应位置上无干扰,见图 3。
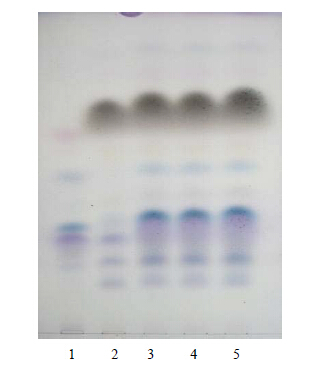 | 1-薄荷素油对照品 2-阴性样品 3~5-清眩软胶囊 1-peppermint oil reference substances 2-negative sample 3—5-Qingxuan Soft Capsule图 3 清眩软胶囊中薄荷的TLC色谱图Fig. 3 TLC Chromatogram of Menthae Haplocalycis Herba in Qingxuan Soft Capsule |
Agilent C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-水(42.5∶57.5)为流动相;检测波长300 nm,柱温为35 ℃,体积流量为1.5 mL/min。理论板数按欧前胡素峰计算应不低于3 000。
2.4.2 对照品溶液的制备取欧前胡素对照品适量,精密称定,加甲醇制成5 μg/mL的溶液,即得。
2.4.3 供试品溶液的制备取清眩软胶囊内容物适量,混匀,取约0.4 g,精密称定,置具塞锥形瓶中,精密加入80%乙醇100 mL,称定质量,在50 ℃左右温水中溶散,放冷,再称定质量,用80%乙醇补足减失的质量,滤过,取续滤液, 即得。
2.4.4 阴性对照溶液的制备按照软胶囊处方配比及制法,制成缺白芷的阴性样品,称取0.39 g,精密称定,置具塞锥形瓶中,按“2.4.3”项方法法制成阴性对照溶液。
2.4.5 专属性试验分别精密吸取欧前胡素对照品溶液、供试品溶液和阴性对照溶液各10 μL,注入HPLC色谱仪,测定。结果样品色谱图中,在与欧前胡素对照品色谱相应的位置上,有一相同保留时间的色谱峰,而阴性对照溶液在此保留时间处无干扰,见图 4。
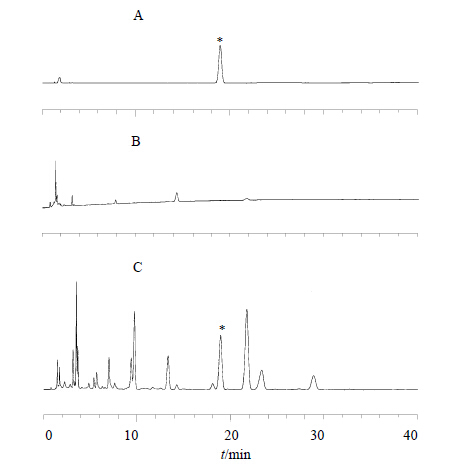 | 图 4 欧前胡素对照品(A)、阴性对照(B)和清眩软胶囊(C)的HPLC图谱Fig. 4 HPLC chromatograms of imperatorin reference substance (A), negative sample (B), and Qingxuan Soft Capsule (C) |
精密称取欧前胡素对照品21.82 mg,置20 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀,作为对照品储备液。将此储备液逐级稀释至1.09、2.18、8.73、21.82、54.55 μg/mL,摇匀,即得。分别进样10 μL,测定。以质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,进行线性回归,得回归方程Y=5.5×10−8 X-6.9×10−5,r=0.999 9。结果表明,欧前胡素在1.09~54.55 μg/ mL与峰面积呈良好的线性关系。
2.4.7 精密度试验精密称取批号120101清眩软胶囊样品,制得供试品溶液,进样10 μL,连续进样6次,测定欧前胡素峰面积积分值,计算得其RSD值为0.18%。
2.4.8 重现性试验精密称取批号120101清眩软胶囊样品,平行制得6份供试品溶液,分别进样10 μL,测定欧前胡素峰面积。结果欧前胡素平均质量分数为0.85 mg/粒,RSD值为1.5%。
2.4.9 稳定性试验精密称取批号120101清眩软胶囊样品,制备供试品溶液,室温放置,分别于0、2、4、8、12、24 h进样测定,测得欧前胡素峰面积积分值,计算得其RSD值为1.05%,表明供试品溶液在24 h稳定。
2.4.10 加样回收率试验取批号120101清眩软胶囊供试品6份,每份0.2 g,精密称定,分别置100 mL置具塞锥形瓶中,精密吸取3.727 5 μg/mL欧前胡素对照品储备液100 mL,制备供试品溶液,分别进样测定。结果平均回收率为97.0%,RSD值为0.77%。
2.4.11 样品测定取3批(批号分别为120101、120102、120103)清眩软胶囊,制备供试品溶液,在上述色谱条件下测定,按外标法计算其质量分数,结果见表 1。
| 表 1 清眩软胶囊中欧前胡素的测定结果(n=3) Table 1 Determination of imperatorin in Qingxuan Soft Capsule (n=3) |
在薄荷TLC法鉴别试验过程中,曾考虑展开方式采用一次展开、展距8 cm,相对应的薄层色谱主斑点多为复合斑点,斑点模糊,分离效果差;后采用二次展开、展距8 cm,结果分离效果稍佳,但整个展开过程耗时较长;最后采用一次展开、展距15 cm,结果色谱斑点清晰,分离效果明显改善。因此,薄荷鉴别的展开方式采用一次展开、展距15 cm。
采用TLC法对清眩软胶囊中的川芎、荆芥穗和薄荷进行了定性鉴别,结果各自的阴性对照无干扰,斑点清晰,分离良好,重现性好,可作为清眩软胶囊的质量控制的定性鉴别方法。
3.2 测定方法的选择参考文献报道[2, 3]和《中国药典》方法[4],采用甲醇超声提取清眩软胶囊中欧前胡素,结果欧前胡素的量均较低,可能是清眩软胶囊内容物为油状混悬物,采用该方法不能完全提取有效成分。因而,本实验采用80%乙醇在50 ℃左右温水中溶散的处理方法时欧前胡素的量最高。
用不同体积分数的甲醇[2, 3, 4]以及甲醇和乙腈的混合流动相,结果供试品色谱图中欧前胡素峰与其相邻峰未完全分离,而采用不同比例的乙腈[5]进行比较,结果42.5%乙腈分离效果较好。故选择流动相为乙腈-水(42.5∶57.5)。
| [1] | 卫生部药品标准[S]. 中药成方制剂第4册. WS3-B-0836-91. |
| [2] | 何鸽飞, 易纯, 张顺芝. 高效液相色谱法测定清眩片中欧前胡素的含量[C]. 2009年中国药学大会暨第九届中国药师周论文集. 长沙: 中国药学会, 2009: 171-173. |
| [3] | 毛彦杰, 岳敏, 谷学新, 等. HPLC测定清眩丸中欧前胡素的含量[J]. 中成药, 2005, 27(5): 618-619. |
| [4] | 中国药典[S]. 一部. 2010: 1127. |
| [5] | 谭生建, 狄海涛, 卢嘉琪, 等. RP-HPLC测定清眩丸中欧前胡素的含量[J]. 药物分析杂志, 1999, 19(3): 177-178. |
 2014, Vol. 29
2014, Vol. 29

