2. 石药集团中诺药业(石家庄)有限公司, 河北 石家庄 050000;
3. 石药集团恩必普药业有限公司, 河北 石家庄 050000
2. Shijiazhuang Pharma Group Zhongnuo Pharmaceutical (Shijiazhuang) Co., Ltd., Shijiazhuang 050000, China;
3. Shijiazhuang Pharma Group NBP Pharmaceutical Co., Ltd., Shijiazhuang 050000, China
瑞舒伐他汀钙是降血脂类固体口服制剂瑞舒伐他汀钙片的主要成分,化学名称为双-[(E)-7-[4-(4-氟基苯基)-6-异丙基-2-[甲基(甲磺酰基)氨基]-嘧啶- 5-基](3R,5S)-3,5-二羟基庚-6-烯酸]钙盐,结构见图 1。有关物质研究作为化学药药学研究的重点,是国家药品审评过程中较为关注的一项重要技术指标。近年,国家出版、刊登了大量有关物质研究的指导原则和研究报道[1, 2, 3, 4]。因此,建立良好、有效的有关物质检测方法在药物研发中非常重要。本文参照现有标准[5, 6, 7],建立了瑞舒伐他汀钙原料药中有关物质的检测方法,对杂质限度进行了修订。结果证明所制定方法合理有效,重复性好,准确度高。
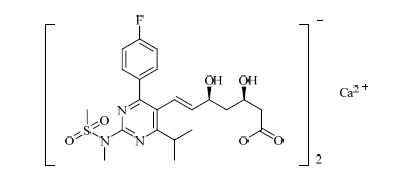 | 图 1 瑞舒伐他汀钙的结构Fig. 1 Structure of rosuvastatin calcium |
Agilent HP 1100高效液相色谱仪;XA205型电子分析天平(梅特勒-托利多公司)。
瑞舒伐他汀钙对照品(批号090701,质量分数为99.7%)、瑞舒伐他汀内酯(批号090202,质量分数为98.0%)、瑞舒伐他汀钙非对映异构体(批号090301,质量分数为99.0%)、瑞舒伐他汀钙原料药(批号分别为090901、090902、090903,规格25 kg/桶)均购自石药集团中奇制药技术(石家庄)有限公司。乙腈为色谱纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果 2.1 色谱条件Phenomenex Luna C18 (2)色谱柱(250 mm×4.6 mm,5 μm),流动相为水-乙腈-1%三氟乙酸水溶液(62∶37∶1),体积流量为1.0 mL/min,柱温为40 ℃,进样量为20 μL,检测波长为242 nm。
2.2 溶液的制备 2.2.1 供试品溶液的制备取瑞舒伐他汀钙原料药适量,精密称定,加乙腈-水(30∶70)溶解并稀释至刻度,配成质量浓度为0.5 mg/mL供试品溶液。
2.2.2 1%自身对照溶液的制备精密量取0.5 mg/mL瑞舒伐他汀钙原料药供试品溶液1 mL,置100 mL量瓶中,加乙腈-水(30∶70)稀释至刻度,摇匀,即得。
2.3 系统适用性试验 2.3.1 1%光降解产物Ⅰ、Ⅱ储备溶液的制备称取瑞舒伐他汀钙对照品25 mg,置50 mL量瓶中,加乙腈15 mL,超声使其溶解,加水稀释至刻度,摇匀;量取此溶液10 mL置洁净的玻璃小瓶中,将小瓶于20 ℃置15 000~25 000 lx·光照下照射2 h,调节光照时间以获得等量的光降解产物Ⅰ和Ⅱ。将光照后的溶液转移至25 mL量瓶中,加乙腈5 mL振摇,加水稀释至刻度,摇匀,即得。
2.3.2 0.5%氧化降解产物的制备取瑞舒伐他汀钙对照品250 mg,置量瓶中,于50 ℃加热7 d,放冷,即得。
2.3. 系统适用性试验溶液的制备称取约含0.5%氧化降解产物25 mg、瑞舒伐他汀内酯和瑞舒伐他汀非对映异构体对照品各10 mg,置同一50 mL量瓶中,加乙腈15 mL,超声使其溶解,加光降解产物Ⅰ和Ⅱ的储备溶液2 mL,用水稀释至刻度,摇匀,即得。
精密量取系统适用性试验溶液,注入液相色谱仪,记录色谱图,见图 2。理论板数按主成分峰计算为20 577,主成分峰与最近杂质峰以及各杂质峰之间均能有效分离,分离度符合规定。
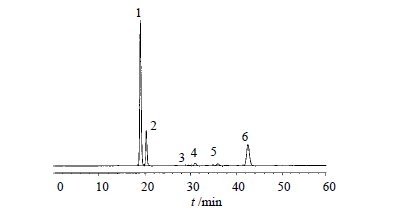 | 1-瑞舒伐他汀钙 2-非对映异构体 3-氧化产物 4-光降解产物Ⅰ 5-光降解产物Ⅱ 6-瑞舒伐他汀内酯 1-rosuvastatin calcium 2-non enantiomer 3-oxidation product 4-photodegradation productⅠ 5-photodegradation product Ⅱ 6-rosuvastatin lactone图 2 系统适用性试验溶液的HPLC图谱Fig. 2 HPLC chromatograms of system suitability solution |
制备0.5 mg/mL瑞舒伐他汀钙原料药(批号090903)供试品溶液和1%自身对照溶液,分别进样,重复测定6次,结果见表 1。
| 表 1 系统精密度试验结果 Table 1 Results of system precision test |
平行制备6份0.5 mg/mL瑞舒伐他汀钙原料药(批号090903)供试品溶液和1%自身对照溶液,分别进样,结果见表 2。表明RSD最大值为14.1%,小于20%,提示方法精密度良好。
| 表 2 方法精密度试验结果 Table 2 Results of method precision test |
有关物质按照瑞舒伐他汀钙1%自身对照法进行检测。因此,在1%自身对照溶液浓度的20%~200%进行线性考察。精密量取0.5 mg/mL瑞舒伐他汀钙对照品溶液2 mL,置100 mL量瓶中,加乙腈-水(30∶70)稀释至刻度,制成1%自身对照溶液浓度的200%溶液。精密移取上述溶液8、5、2、1 mL,置10 mL量瓶中,加乙腈-水(30∶70)稀释至刻度,制成1%自身对照溶液浓度的160%、100%、40%、20%的溶液。将上述5个浓度溶液分别进样,记录色谱图。以峰面积为纵坐标,进样质量为横坐标,进行线性回归,得方程Y=938 127.5 X-5 326.1(r=0.999 8)。表明瑞舒伐他汀钙在0.020 1~0.201 3 μg与峰面积有良好的线性关系。
2.7 稳定性试验取0.5 mg/mL瑞舒伐他汀钙原料药(批号090903)供试品溶液,放置0、1、2、4、8、10 h后分别进样,考察杂质氧化产物、内酯、光降解产物、非对映异构体、其他最大单杂和总杂的变化。结果表明,氧化产物、内酯、光降解产物、非对映异构体、其他最大单杂和总杂几乎无明显变化,表明本品溶液在10 h内稳定。
2.8 检测限测定将0.5 mg/mL瑞舒伐他汀钙、氧化产物、内酯、光降解产物Ⅰ和Ⅱ和非对映异构体的对照品溶液分别逐步进行稀释,进样,记录色谱图,按信噪比3∶1测得瑞舒伐他汀钙的检测限为2.76 ng,氧化产物、内酯、光降解产物Ⅰ和Ⅱ和非对映异构体各杂质的检测限依次为1.85、1.32、1.08、1.11、2.06 ng。
2.9 有关物质限度的确定参考国家药品监督管理局药品标准YBH04162008、YBH08932008以及稳定性检测结果,拟定瑞舒伐他汀钙氧化产物、内酯、非对映异构体限度均不得超过0.5%,光解产物Ⅰ、Ⅱ均不得过0.2%,其他最大单杂不得超过0.5%,总杂不得超过1.5%。
2.10 样品测定取瑞舒伐他汀钙原料药3批样品,制备供试品溶液,按上述条件进行测定,结果见表 3。
| 表 3 瑞舒伐他汀钙样品有关物质测定结果 Table 3 Determination of related substances in rosuvastatin calcium samples |
瑞舒伐他汀钙有关物质现有测定方法中,标准YBH04162008中控制已知杂质个数为1;而YBH08932008没有控制已知杂质,且有关物质检测方法为梯度洗脱,在操作过程中容易引起基线噪声干扰;瑞舒伐他汀钙片进口注册标准JX20030283中有关物质测定方法为等度,色谱系统易操作,对2个已知杂质进行了控制。
为了更好地控制药品质量,本实验以瑞舒伐他汀钙片进口注册标准JX20030283为参考,依据《中国药典》2010年版二部附录药品杂质分析指导原则,对进口注册标准JX20030283中有关物质的个数和限度进行了修订,严格控制了氧化产物、内酯、非对映异构体、光解产物Ⅰ和Ⅱ 5个杂质。光解产物Ⅰ和Ⅱ为样品处理过程中受光照射产生,通过避光操作可以避免,因此拟定限度均不得过0.2%。为了有效防止光解产物Ⅰ和Ⅱ的产生,本测定方法采取避光操作。
本法合理严谨,方法精密度好,检测灵敏度高,因此可准确用于瑞舒伐他汀钙原料药中有关物质的检测。
| [1] | 中国药典[S]. 二部. 2010: 附录204-206. |
| [2] | 谢沐风, 罗霞萍, 陈亚美. 如何建立HPLC法测定有关物质的方法[J]. 中国药品标准, 2002, 3(6): 326-328. |
| [3] | 张玉琥, 仿制药有关物质研究的特点及研究思路[J]. 中国执业药师, 2009, 6(8): 31-34. |
| [4] | 余振喜, 庾莉菊, 黄海伟, 等. 浅谈HPLC法测定有关物质时已知杂质的计算方法[J]. 中国药品标准, 2010, 11(4): 278-282. |
| [5] | 国家食品药品监督管理局药品标准YBH04162008[S]. 2008. |
| [6] | 国家食品药品监督管理局药品标准YBH08932008[S]. 2008. |
| [7] | 国家食品药品监督管理局瑞舒伐他汀钙片进口注册标准JX20030283[S]. 2003. |
 2014, Vol. 29
2014, Vol. 29


