2. 中国药科大学 药学医学基础实验中心, 江苏 南京 210009
2. Experimental and Teaching Center of Medical Basis for Pharmacy, China Pharmaceutical University, Nanjing 210098, China
维生素A是人体必须的营养素之一,在体内存在视黄醇、视黄酸和视黄醛3种形式[1]。视黄醇在酶的作用下氧化成视黄醛,进一步被催化氧化生成视黄酸,其中第一步是内源性视黄酸生成的限速步骤[2]。已有研究显示视黄醇在维持眼的功能方面发挥重要的作用,是维持机体生理功能重要的维生素,缺乏这种维生素,会引起夜盲症、角膜干燥症和角膜软化症[3]。除参与视觉调节外,维生素A也参与其他系列生理过程,如胚胎的生长发育,细胞的增殖、分化和凋亡,免疫以及炎症反应等[4, 5]。视黄酸是核受体视黄醇X受体内源性配基,通过激动X受体调节众多目的基因表达[6, 7]。当体内视黄醇的代谢出现转化障碍时,症状最先出现在眼内,表现为夜盲症[8]。高效液相色谱法因其具有高分离效能、灵敏快速、可自动化等优点,目前已广泛用于儿童血清[9]、鸡血清[10]、保健食品[11]及婴儿奶粉[12]中维生素A的测定。本研究拟采用高效液相色谱紫外法测定大鼠血清中视黄醇和视黄酸,为建立操作简便、准确、灵敏、专属性强的测定大鼠血清中视黄醇和视黄酸浓度的方法及其在大鼠体内药动学研究提供参考。
1 仪器与材料LC—10ADVP高效液相色谱仪、SPD—10A紫外检测器(日本Shimadzu公司);HW-2000色谱工作站(上海卓典有限公司);Milli—Q Gradient A10超纯水器(美国Millipore公司);5810R台式高速冷冻离心机(德国Eppendorf公司);Min—2800D型氮吹仪(天津奥特赛恩斯仪器有限公司);XW—80AC型涡旋混合器(上海医科大学仪器厂);85—2型恒温磁力搅拌器(上海司乐仪器厂);B5—110S电子天平(北京赛多利斯公司)。
视黄醇、视黄酸、丁羟甲苯对照品(Sigma公司,质量分数≥95%);甲醇、乙腈为色谱纯(德国Merck 公司);实验用水为超纯水。
成年健康雄性SD大鼠,体质量160~180 g,由南京青龙山实验动物中心提供,动物许可证号SCXK(浙)2008-0033,适应饲养1周后进行试验。
2 方法与结果 2.1 溶液的配制 2.1.1 对照品溶液的配制精密称取视黄醇、视黄酸对照品各10 mg,置于10 mL量瓶中,加甲醇溶解(超声助溶)并稀释至刻度,摇匀,即得1 mg/mL视黄醇、视黄酸储备液。于−80 ℃冰箱保存待用。临用时以甲醇稀释至相应的浓度。
2.1.2 丁羟甲苯溶液的配制精密称取丁羟甲苯10 mg置于100 mL量瓶中,加乙腈溶解(超声助溶)并稀释至刻度,摇匀,即得100 μg/mL溶液,于4 ℃冰箱备用。
2.2 色谱条件色谱柱为Phenomenex Luna C18柱(150 mm×4.6 mm,5 μm),柱温为40 ℃;流动相为甲醇-10 mmol/L乙酸铵缓冲盐(90∶10,乙酸调整水相pH值至4);体积流量为1.0 mL/min;检测波长为340 nm;进样量为20 μL;灵敏度为0.01 AUFS。
2.3 血清样品处理取100 μL大鼠血清样品置于2.0 mL离心管中,加入终浓度100 μg/mL丁羟甲苯的乙腈溶液200 μL,涡旋混匀,再加800 μL正己烷提取,涡旋混匀3 min,2 000 r/min离心10 min,取上清液0.6 mL。重复3次,合并上清液于N2吹干,残渣用100 μL甲醇复溶,2 000 r/min离心10 min,取20 μL进样。
2.4 专属性试验在以上色谱条件下考察空白血清、空白血清加视黄醇或视黄酸对照品、血清样品的色谱行为,见图 1。结果峰形良好,分离完全,基线噪音小,血清中的杂质峰不干扰样品测定,血清中视黄醇和视黄酸保留时间分别为6.7、13.9 min。
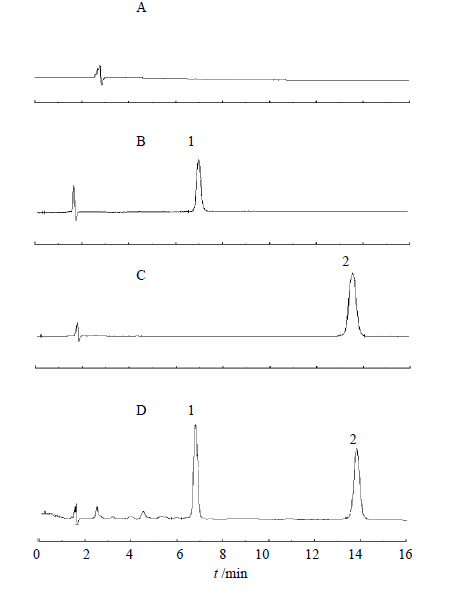 | 1-视黄醇 2-视黄酸 1-retinol 2-retinoic acid图 1 空白血清(A)、视黄醇对照品(B)、视黄酸对照品(C)、大鼠血清(D)高效液相色谱图Fig. 1 HPLC chromatograms of blank rat serum (A), retinol reference substance (B), retinoic acid reference substance (C), and rat serum sample (D) |
取空白血清100 μL,精密加入视黄醇、视黄酸储备液,使其浓度分别为31.25、62.5、125、250、500、1 000 ng/mL,按2.3血清样品处理项下操作,记录样品峰面积。以质量浓度对峰面积作直线回归,得回归方程。视黄醇Y=205 938 X+52.22,r=0.999 9,线性范围31.25~1 000 ng/mL;视黄酸Y=201 883 X- 1 043.2,r=0.999 9,线性范围31.25~1 000 ng/mL。
2.6 精密度试验精密配制视黄醇、视黄酸质量浓度为62.5、125、250 ng/mL血清样品各5管,按2.3血清样品处理项下方法操作,1 d测定5次,计算日内精密度。连续测定5 d,计算日间精密度,见表 1。结果表明3组不同质量浓度的视黄醇、视黄酸样品批内变异和连续5 d内的批间RSD值均小于10%,符合生物样品测定的方法学要求。
| 表 1 精密度试验结果(n=5) Table 1 Results of precision test (n=5) |
精密配制视黄醇、视黄酸质量浓度为62.5、125、250 ng/mL血清样品,每个质量浓度进行3个样品,按2.3血清样品处理项下方法操作,以血样中视黄醇、视黄酸的峰面积与相同质量浓度视黄醇、视黄酸对照品溶液的峰面积的比值计算提取回收率,见表 2。结果表明3组不同浓度的视黄醇、视黄酸样品提取回收率均大于90%。
| 表 2 回收率试验结果(n=5) Table 2 Results of recovery test (n=5) |
精密配制视黄醇、视黄酸质量浓度为62.5、125、250 ng/mL血清样品,每个浓度10份样品,5份样品立即分别测定样品中视黄醇、视黄酸浓度。剩余的5份样品放置−70 ℃冰箱冷藏1周,37 ℃恒温水浴解冻后,按2.3血清样品处理项下方法操作,分别测定大鼠血清样品中视黄醇、视黄酸的浓度,见表 3。结果表明视黄醇、视黄酸在血清样品中较稳定,受冻融操作影响较小。1周内无明显变化,其RSD值均在10%以下,符合生物样品测定的方法学要求。
| 表 3 稳定性试验结果(n=10) Table 3 Results of stability test (n = 10) |
取SD大鼠6只,试验前1 d禁食12 h,自由饮水,ig 45 mg/kg视黄醇,分别于给药前和给药后1、2、4、6、8、12、18、24、36 h眼眶静脉丛采血0.4 mL,于1.5 mL离心管中静置10 min,2 000 r/min离心10 min,取上清,于−20 ℃保存备用,测定,结果见图 2。结果表明大鼠ig 45 mg/kg视黄醇后,视黄醇峰浓度(Cmax)为(0.62±0.09)μg/mL,达峰时间(tmax)为(4.73±2.41)h,血药浓度-时间曲线下面积AUC0-36 h为(6.65±0.81)μg·h/mL。此外,通过建立的HPLC方法,测定大鼠血清中视黄醇和视黄酸的基础水平分别为(0.43±0.04)、(0.040±0.006)μg/mL。
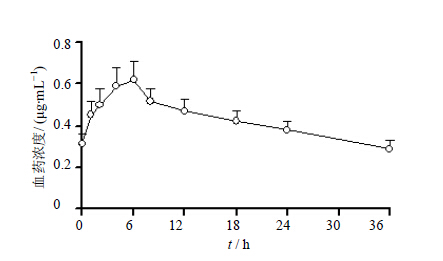 | 图 2 大鼠ig视黄醇45 mg/kg的血药浓度-时间曲线Fig. 2 Serum concentration-time of retinol after ig administration 45 mg/kg of retinol to rats |
所建立的测定方法可以同时测定血清中视黄醇和视黄酸水平,而文献方法多是单独测定视黄醇[13]或视黄酸[14]。视黄醇、视黄酸对光敏感,见光容易分解,在空气中易氧化。为了保证测定结果的准确性,采血后应尽快测定,样品的均在暗室中处理,提取液用氮气吹干。有文献报道采取固相萃取技术处理血液标本的方法可以去除更多杂质,但固相萃取小柱比较昂贵,用于常规检测成本较高,本实验采用正己烷从生物样品提取视黄醇和视黄酸,提取效率达到90%。在提取液和沉淀剂中加入抗氧化剂丁羟甲苯,防止提取过程中视黄酸和视黄醇的降解,以上各种处理均保证了结果的可靠性。
3.2 色谱条件的优化以视黄醇和视黄酸的特征吸收340 nm作为检测波长,血清中其他组分在此波长上没有吸收,避免了杂质对测定的干扰。比较了Phenomenex Luna C18色谱柱、Waters Symmetry C18色谱柱和Shimadzu Inertsil ODS-SP色谱柱,结果表明在Phenomenex Luna C18色谱柱上可以获得分离完全、峰形对称的色谱峰。pH 6逐渐调整pH 4,可以显著改善峰形。
3.3 检测的临床意义已有文献报道血清维生素A>1.05 μmol/L为正常值;血清维生素A水平在0.35~0.70 μmol/L为维生素A含量较低;血清维生素A水平<0.35 μmol/L为维生素A高度缺乏[15]。同时也有文献报道慢性支气管炎患者血浆中视黄酸水平明显低于正常人群。提示视黄酸缺乏与支气管上皮细胞的炎症反应可能有密切关系[16]。因此维持体内视黄醇和视黄酸的正常水平对保持内环境的稳态具有重要意义,测定视黄醇和视黄酸水平具有重要的临床意义。
| [1] | 王萍, 刘晓东. 细胞色素P450酶与维生素A的代谢[J]. 中国临床药理学与治疗学, 2011, 16(4): 474-480. |
| [2] | Aranda A, Pascual A. Nuclear hormone receptors and gene expression[J]. Physiol Rev, 2001, 81(3): 1269-1304. |
| [3] | Luo T, et al. Retinoids, eye development, and maturation of visual function[J]. J Neurobiol, 2006, 66: 677-86 |
| [4] | Zhou R, et al. A new look at immune privilege of the eye: dual role for the vision-related molecule retinoic acid[J]. J Immunol, 2011, 187: 4170-4177. |
| [5] | Kim C H. Retinoic acid, immunity, and inflammation[J]. Vitam Horm, 2011, 86: 83-101. |
| [6] | Aranda A, Pascual A. Nuclear hormone receptors and gene expression[J]. Physiol Rev, 2001, 81: 1269-1304. |
| [7] | Agte V, Tarwadi K. The importance of nutrition in the prevention of ocular disease with special reference to cataract[J]. Ophthalmic Res, 2010, 44: 166-172. |
| [8] | 柴文, 张宁, 王艳青, 等. 孤儿核受体RORs的病理生理作用及其调控机制[J]. 生理科学进展, 2013, 44(2): 87-92. |
| [9] | 曾婧, 辜伟伟, 李兆林, 等. 反相高效液相色谱内标法测定儿童血清中视黄醇的含量[J]. 公共卫生与预防医学, 2012, 23(3): 12-14. |
| [10] | 李彦, 杨在宾, 杨海勇, 等. 反相高效液相色谱法同时测定鸡血清中视黄醇和α-生育酚[J]. 中国粮油学报2009, 24(1): 141-144. |
| [11] | 曾红燕, 邹晓莉, 黎源倩. HPLC同时测定保健食品中维生素A、D3、E和β-胡萝卜素[J]. 分析试验室, 2008, 27(2): 15-18. |
| [12] | 吴小松, 刘沐雨, 曹玉发, 等. HPLC法测定婴儿配方奶粉中维生素A含量的不确定度评定[J]. 食品工业科技, 2013, 34(9): 309-312. |
| [13] | 马红梅. 高效液相色谱法测定血清中的视黄醇[J].中国卫生检验杂志, 2011, 21(11): 2633-2634. |
| [14] | 曲斐, 方志娥, 尚京川. 高效液相色谱法快速测定生物样品中的视黄酸[J]. 分析试验室, 2009, 28(7): 5-8. |
| [15] | 朱建华, 徐群英. 南昌市部分人群的维生素A营养状况调查[J]. 实验与检验医学, 2009, 27(3): 232-234 |
| [16] | 杨平, 李萍. 高效液相色谱法同时测定人血浆三种视黄酸及临床应用[J]. 职业卫生与病伤, 2007, 22(2): 88-91. |
 2014, Vol. 29
2014, Vol. 29


