2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
TSQ Quantum Ultra三重四极杆串联质谱仪,配备大气压化学电离源,Xcalibur 2.0数据采集软件,LCquan 2.5.6定量处理软件(美国Thermo公司),BT25S天平[赛多利斯科学仪器(北京)有限公司],LD5—2A离心机(北京医用离心机厂),HY—2型调速多用振荡器(深圳天南海北实业有限公司),CAY—1型液体快速混合器(北京长安仪器厂),TurboVap蒸发仪(美国Zymark公司)。
1.2 药品与试剂受试制剂非诺贝特双层渗透泵片,含非诺贝特0.25 g/片,批号20090803,江苏康缘药业股份有限公司提供。参比制剂非诺贝特缓释胶囊,含非诺贝特0.25 g/粒,批号100108,上海爱的发制药有限公司提供。非诺贝特酸对照品(批号130352-200405)、酮洛芬对照品(批号130351-200303)均由中国食品药品检定研究院提供。甲醇(色谱纯,天津康科德科技有限公司),甲酸(色谱纯,天津市科密欧化学试剂有限公司),盐酸(分析纯,沈阳经济技术开发区试剂厂),醋酸乙酯(分析纯,天津市大茂化学试剂厂),重蒸水(自制)。
1.3 实验动物健康Beagle犬,体质量8~12 kg,购自沈阳康平实验动物研究所,许可证号为2009-0005。
2 方法与结果 2.1 给药方案与样品采集将6只Beagle犬随机分成2组,每组3只。给药前禁食10 h以上,试验日晨空腹ig受试制剂1片或参比制剂1粒。于给药前(0 h)和给药后0.5、1、2、3、4、5、6、8、10、12、15、24、36、48、72 h自犬前肢静脉取血约1.0 mL,并立即移入经肝素处理的离心试管中,3 000~3 500 r/min离心10 min,分离血浆,于−20°C冰箱中保存待测。
2.2 血浆样品处理取血浆0.1 mL,置10 mL具塞离心试管中,分别加入甲醇-水(50∶50)50 μL、500 ng/mL内标酮洛芬溶液50 μL和0.12 mol/L盐酸溶液50 μL,混匀;加入醋酸乙酯2.0 mL,涡流混合1 min,240次/min往复振荡10 min,3 500 r/min离心5 min,分取上层有机相于另一个试管中,于40 ℃空气流下吹干,残留物加入100 μL流动相溶解,涡流混合,取20 μL进行LC/MS/MS分析。
2.3 色谱条件与质谱条件 2.3.1 色谱条件分析柱为Inertsil ODS-3柱(100 mm×2.1 mm,3 μm);预柱为迪马公司EasyGuard C18保护柱(8 mm×4.0 mm,5 μm);流动相为甲醇-1%甲酸(90∶10);体积流量为0.25 mL/min;柱温为20 ℃;进样量为20 μL。
2.3.2 质谱条件离子源为大气压化学电离源(APCI源),源喷射电压为4.0 kV,汽化室温度为400 ℃,加热毛细管温度为270 ℃;鞘气(N2)压力为30 L/min,辅助气(N2)压力为5 L/min,碰撞气(Ar)压力为23.8 Pa;碰撞诱导解离(CID)电压均为25 eV;正离子方式检测;扫描方式为选择反应监测(SRM);用于定量分析的离子反应分别为m/z 319→139(非诺贝特酸)和m/z 255→105(酮洛芬);扫描时间为0.3 s。
2.4 非诺贝特酸对照品溶液的配制精密称取非诺贝特酸对照品10.0 mg,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得1 mg/mL非诺贝特酸储备液Ⅰ;取1.0 mL储备液Ⅰ,置于10 mL量瓶中,用甲醇-水(50∶50)稀释并加至刻度,即得100 μg/mL储备液Ⅱ。以甲醇-水(50∶50)稀释储备液Ⅱ,配制非诺贝特酸对照品系列溶液。
2.5 内标酮洛芬溶液的配制精密称取酮洛芬对照品10.0 mg,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得1 mg/mL储备液Ⅰ;取5.0 mL储备液Ⅰ,置于10 mL量瓶中,用甲醇-水(50∶50)稀释并加至刻度,即得500 μg/mL的储备液Ⅱ;取0.1 mL储备液Ⅱ,置于100 mL量瓶中,用甲醇-水(50∶50)稀释并加至刻度,即得500 ng/mL内标溶液。
2.6 专属性试验取Beagle犬的空白血浆0.1 mL,除不加内标溶液外,其余按2.2项下血浆样品处理方法操作;取Beagle犬的空白血浆0.1 mL,加入40.0 ng/mL非诺贝特酸对照品溶液50 μL和500 ng/mL内标溶液50 μL,按2.2项下血浆样品处理方法操作;另取Beagle犬ig非诺贝特受试制剂0.25 g后2 h的血浆样品,按2.2项下血浆样品处理方法操作。以上样品均进样20 μL,得色谱图。结果表明:非诺贝特酸和内标酮洛芬的保留时间分别为2.69、2.20 min,空白血浆中的内源性物质不干扰测定。
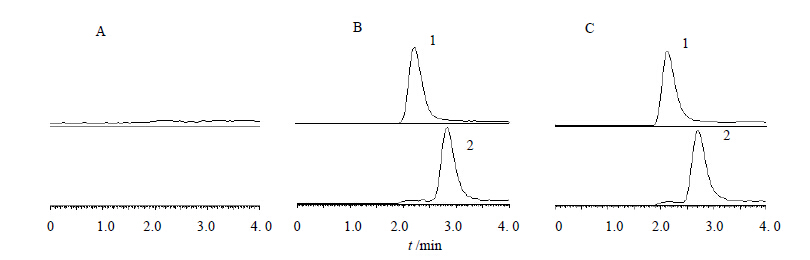 | 1-酮洛芬 2非诺贝特酸 1-ketoprofen 2- fenofibric acid图 1 血浆(A),血浆+对照品+内标物(B)和血浆样品(C)中非诺贝特酸及内标酮洛芬的SRM色谱图Fig. 1 SRM chromatogram of plasma(A), plasma + fenofibric acid + ketoprofen (internal standard), and sample (C) |
取空白血浆0.1 mL,加入非诺贝特酸对照品系列溶液50 μL,配制成相当于非诺贝特酸血浆浓度为10、20、50、200、500、2 000、5 000 ng/mL样品,按2.2项下血浆样品处理方法操作,每一个浓度进行双样本分析,进样20 μL,记录色谱图;以待测物质量浓度为横坐标,待测物与内标的峰面积比值为纵坐标,用加权最小二乘法进行回归运算,得回归方程Y=5.727×10−3 X-9.582×10−3(r2= 0.995 6),结果表明非诺贝特酸在10~5 000 ng/mL线性关系良好。
2.8 精密度试验取空白血浆0.1 mL,按2.7标准曲线的绘制项下的方法配制低、中、高3个质量浓度(非诺贝特酸血浆质量浓度分别为20、500、4 000 ng/mL)的样品,每一个质量浓度各6份,按照2.2血浆样品处理项下方法处理,进样分析,连续测定3 d,计算日内及日间精密度,结果见表 1。
| 表 1 精密度试验结果 Table 1 Results of precisions test |
取空白血浆0.1 mL,按2.7标准曲线的绘制项下的方法配制低、中、高3个质量浓度(非诺贝特酸血浆浓度分别为20、500、4 000 ng/mL)的样品,每一个浓度进行6个样本分析。同时另取空白血浆0.1 mL,除不加内标溶液外,按照2.2血浆样品处理项下方法操作,向获得的上清液中加入相应浓度的对照品溶液50 μL和内标溶液50 μL,涡流混合,40 ℃空气流下吹干。残留物以流动相溶解,进样分析,获得相应峰面积(3次测定的平均值)。以每一个浓度两种处理方法的峰面积比值计算提取回收率,见表 2。结果表明,所建立的测定Beagle犬血浆中非诺贝特酸的分析方法符合《中国药典》要求,可用于非临床药动学试验。
| 表 2 提取回收率试验结果 Table 2 Results of extraction recovery |
分别考察了血浆样品经液-液萃取处理后室温放置24 h、血浆样品室温放置4 h、血浆样品经历3次冷冻-解冻循环及血浆样品于−20 ℃冷冻放置60 d的稳定性,结果见表 3。可见血浆样品经上述条件处理和放置后比较稳定。
| 表 3 血浆样品稳定性试验结果 Table 3 Stability results of fenofibric acid in plasma |
采用DAS 2.1.1数据处理软件,计算Beagle犬ig受试制剂和参比制剂后的药动学参数,结果见表 4。平均血药浓度-时间曲线见图 2。
 | 图 2 分别ig非诺贝特受试制剂和参比制剂后非诺贝特酸的平均药时曲线Fig. 2 Mean plasma concentration-time curve of fenofibric acid after ig administration of test preparation and reference preparation |
| 表 4 受试制剂和参比制剂中非诺贝特酸药动学参数 Table 4 Pharmacokinetic parameters of fenofibric acid after ig test preparation and reference preparation |
以统计矩方法统计结果中的AUC0-t,计算相对生物利用度(F)。结果受试制剂中非诺贝特酸的平均相对生物利用度为(104.7±12.4)%。
F=AUC0-t(test)/AUC0-t(reference)
2.13 统计学分析(生物等效性评价)采用DAS 2.1.1软件,对药动学参数进行统计学分析。
2.13.1 方差分析受试制剂与参比制剂的AUC0-t、AUC0-∞、Cmax方差分析结果见表 5。结果显示,上述参数数据在制剂间和周期间的差异无统计意义,在个体间的差距有统计学意义(P<0.05)。
| 表 5 主要药动学参数方差分析结果 Table 5 ANOVA results of main pharmacokinetic parameters |
AUC0-t、AUC0-∞、Cmax双向单侧t检验结果及[1-2α]置信区间分析见表 6。结果显示受试制剂中,非诺贝特酸的AUC0-t的90%置信区间为参比制剂的93.5%~115.9%,AUC0-∞的90%置信区间为参比制剂的89.3%~124.2%,Cmax的90%置信区间为参比制剂的91.2%~129.9%。
| 表 6 药动学参数双单侧检验和[1-2α]置信区间检验结果 Table 6 The t-test and confidence interval results of main pharmacokinetic parameters |
采用LC-MS-MS法测定了Beagle犬血浆中非诺贝特酸,并进行了方法确证。血浆样品经液-液萃取后,采用APCI源,以SRM扫描方式进行定量分析,血浆中的内源性物质不干扰待测物的测定。本方法具有快速、准确、灵敏度高等特点,适合非诺贝特双层渗透泵片在Beagle犬体内的生物利用度和生物等效性研究。
采用交叉给药的方式进行了受试制剂和参比制剂在Beagle犬体内的药动学研究,经统计学分析后,受试制剂和参比制剂各药动学参数差异无显著性,因此可认为非诺贝特双层渗透泵片与缓释胶囊具有生物等效性。
| [1] | 李卫中, 张峻菁, 卢君强. 非诺贝特缓释胶囊体外释放度及释药机制的研究[J]. 今日药学, 2010, 20(4): 34-36. |
| [2] | 孙光美, 杨星钢, 聂淑芳, 等. 非诺贝特双层渗透泵制剂的处方优化[J]. 中国药剂学杂志: 网络版, 2009, 7(4): 212-217. |
| [3] | 李晓祥, 赵亚男, 周理想. 非诺贝特缓释片人体药代动力学及生物等效性研究[J]. 安徽医药, 2009, 13(7): 732-734. |
| [4] | 赵永红, 黄毅慧, 黄仲义. 非诺贝特胶囊(微粒化)人体生物利用度研究[J]. 中国药房, 2006, 17(14): 1082-1083. |
| [5] | 左素兰, 吕娜, 丁桂真. 非诺贝特缓释胶囊治疗原发性高脂血症的疗效观察[J]. 中西医结合心脑血管病杂志, 2003, 1(8): 489. |
| [6] | 沈敏, 李中东. 非诺贝特非调脂作用的研究与应用[J]. 中国临床药学杂志, 2010, 19(4): 253-256. |
| [7] | 何勇, 夏涛. HPLC法测定非诺贝特胶囊的含量[J]. 安徽医药, 2004, 9(2): 118-119. |
 2014, Vol. 29
2014, Vol. 29


