2. 中国人民解放军第401医院 药剂科, 山东 青岛 266071
2. Department of Pharmacy, No. 401 Hospital of Chinese People's Liberation Army, Qingdao 266071, China
肺癌是世界上高死亡率的恶性肿瘤之一,每年死于肺癌的病人约有138万人[1]。在所有的肺癌患者中非小细胞肺癌约占80%,其中有1/3的非小细胞肺癌患者被诊断出疾病时已经是肺癌晚期,并伴有转移[2];伴有转移的患者生存期很短,一般低于2年。近年来,随着人们对肺癌的病理和生化特点的深入研究,分子靶向治疗非小细胞肺癌已经成为一个热门的研究领域。表皮生长因子受体(EGFR)信号转导通路及其酪氨酸激酶(TK)已经成为一个重要的靶点来治疗非小细胞肺癌。很多肿瘤细胞,包括非小细胞肺癌被检测出表皮生长因子酪氨酸激酶受体高表达,这种高表达的TK在肿瘤细胞的增殖、分化、侵袭和转移过程起着非常关键的作用[3]。吉非替尼是一种口服的小分子靶向药物,在临床上已经得到了广泛的应用,用于治疗曾接受过铂类化疗药物的晚期非小细胞肺癌[4]。
从单细胞生物到复杂的哺乳动物,生物节律性是广泛存在的[5]。在哺乳动物中,生物钟的调节中心位于下丘脑前部的视交叉上核[6, 7]。有研究发现癌症的发生与生理节律性失调有密切关系[8]。Filipski等[9]发现机体的生物钟在控制肿瘤生长方面起着关键的作用。目前发现很多化疗药物的疗效存在节律性,如5-氟尿嘧啶、柔比多星和奥沙利铂等[10, 11, 12]。但是未见关于吉非替尼在时辰药理学方面的相关报道,临床用药也没有规定具体的给药时间。因此,本文旨在研究吉非替尼时辰给药荷瘤小鼠的药效学特点,为进一步临床研究提供参考依据。
1 实验材料 1.1 仪器DW—86WHO型−86 ℃低温保存箱(澳柯玛公司);AE240型电子天平(美国Mettler公司;JM—A型电子天平(余姚市纪铭校验设备有限公司);光学显微镜(上海光学仪器厂);TGL16型台式高速冷冻离心机(长沙英泰仪器有限公司);CB150型CO2培养箱(德国Binder公司);S—4800型扫面电子显微镜(日本日立公司);ELX—800型全自动酶标仪(美国BIO-TEK公司)。
1.2 动物SPF级C57BL/6小鼠,雌性,5周龄,体质量18~20 g,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(京)2012-0001。每个笼子4只小鼠,置于标准的明/暗周期饲养(明期:7:00—19:00,暗期:19:00—7:00),自由进水进食,室内温度为(24±1)℃,湿度(60±10)%。
1.3 细胞Lewis肺癌细胞购于北京北纳创联生物技术研究院,货号ATCC CRL-1642。
1.4 药品和试剂吉非替尼片(商品名易瑞沙,生产批号JT926,规格250 mg/片,阿斯利康制药有限公司)。高糖培养基(货号SH30002.02,规格500 mL/瓶)、胰蛋白酶(批号NWK0489,规格500 mL/瓶)、胎牛血清(批号10132222,规格500 mL/瓶)、青霉素/链霉素双抗(货号SV30082.01,规格100 mL/瓶)均购于美国HyClone公司。小鼠IL-6 ELISA试剂(货号431307,美国Biolegend公司)。
2 方法 2.1 建立Lewis肺癌小鼠模型Lewis肺癌细胞培养在含10%胎牛血清和双抗的高糖培养基中,并在37 ℃、5% CO2条件下进行传代,收集对数期的肺癌细胞,调整细胞悬液浓度至1×106/mL,与小鼠右后肢内侧sc 0.2 mL该细胞悬液,接种7 d后肉眼可见肿瘤,即为肺癌小鼠模型构建成功[13]。肿瘤直径生长至5 mm左右时即可进行分组。分组时肿瘤直径大于8 mm和小于3 mm的荷瘤小鼠均被排除。
2.2 分组和给药取56只建立模型成功的荷瘤小鼠,将其随机分成7组,每组8只,分别为对照组,8:00、12:00、16:00、20:00、24:00和次日4:00时给药的实验组(A、B、C、D、E、F组)。实验组ig给予吉非替尼混悬液(5%羧甲基纤维素钠助悬剂),剂量为50 mg/kg。对照组给予相同体积含5%羧甲基纤维素钠的蒸馏水。
2.3 时辰给药对其抗肿瘤活性的影响 2.3.1 荷瘤小鼠生存质量和肿瘤体积的记录每天观察并记录荷瘤小鼠的生存质量和毛的颜色,每3天用游标卡尺测定小鼠肿瘤的长径和短径。计算肿瘤的体积(体积=长径×短径2/2)。
2.3.2 肿瘤质量和抑瘤率的计算经3周给药后,第22天在相应给药时间点以颈椎脱臼法处死小鼠,剥离肿瘤并测定肿瘤的质量,计算吉非替尼的抑瘤率[13]。
抑瘤率=(对照组平均肿瘤质量-实验组平均肿瘤质量)/对照组平均肿瘤质量
2.3.3 组织病理学检查将剥离的的肿瘤组织固定于中性的福尔马林48 h,用乙醇脱水后石蜡包埋,连续5 μm切片,HE染色,光镜观察。
2.4 时辰给药对其毒性作用的影响 2.4.1 皮肤细胞形态学观察取各组小鼠的皮肤组织,固定于含有2.5%戊二醛的磷酸盐缓冲液(pH 7.2)1 h,然后固定于含有1%的锇酸1 h,用不同体积分数乙醇进行脱水,用临界点干燥法干燥后镀膜进行扫描,电子显微镜观察。
2.4.2 荷瘤小鼠肛周红肿的测定时辰给药期间,每天记录出现肛周红肿的荷瘤小鼠的数量,用于衡量不同给药时间对吉非替尼所致腹泻的影响。
肛周红肿率=肛周红肿小鼠只数/每组小鼠的样本量
2.4.3 荷瘤小鼠血清中IL-6水平的测定在处死小鼠以前对其进行眼眶静脉取血,每只小鼠取0.5 mL血液标本,12 000 r/min离心10 min分离出血清,用IL-6试剂盒按着说明书要求进行操作,用酶标仪在450 nm处测定每个标本的吸光度值。
2.5 统计学方法所有的数据用`x ± s表示,采用SPSS 19.0进行统计学分析,组间比较选用单因素方差分析,率的比较采用χ2检验。
3 结果 3.1 时辰给药对其抗肿瘤活性的影响 3.1.1 荷瘤小鼠的生存质量和肿瘤体积给药1周后,与对照组相比,A、B、F组的小鼠行动比较活跃,反应较为灵敏,毛色也鲜亮;C、D、E组的小鼠运动较为迟缓、反应迟钝、毛色暗淡。
随着实验的进展,各组肿瘤体积逐渐增大,其中对照组的小鼠肿瘤增长最为迅速,尤其是实验后期;与对照组比较,A~F组的肿瘤生长较为缓慢,与其他实验组相比,A组的平均肿瘤体积最小,F组次之,在所有的实验组中C组的肿瘤长得最快(P<0.05)。见图 1。
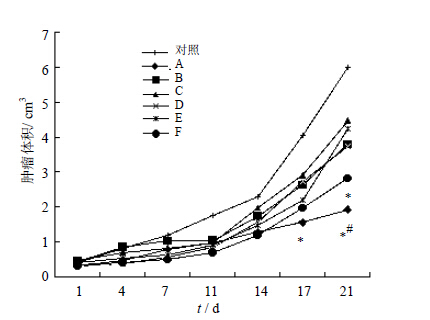 | 与B、C或E组比较:*P<0.05 *P< 0.05 vs B, C or E group 图 1 各组肿瘤体积增长曲线(n=8)Fig. 1 Growth curves of tumor volume from each group (n=8) |
时辰给药吉非替尼对瘤质量和抑瘤率有明显的影响。A组的瘤质量最小而抑瘤率最高(P<0.05),而C组的瘤质量最大且抑瘤最低,F组的抑瘤率比A组稍小,差异无统计学意义。见表 1。
| 表 1 各组的肿瘤质量和抑瘤率(x±s,n=8) Table 1 Tumor weight and tumor inhibition rate in mice from each group(x±s,n=8) |
对照组的肿瘤细胞排列紧密,为低分化腺癌,边界比较清晰;A组和F组的肿瘤组织出现大量的灶型坏死,细胞排列较稀疏,纤维间质较少;尽管B、C、D、E组肿瘤也出现了坏死,但是与A组相比肿瘤组织坏死程度明显降低,C组肿瘤组织坏死最少,细胞的分化程度较低。见图 2。
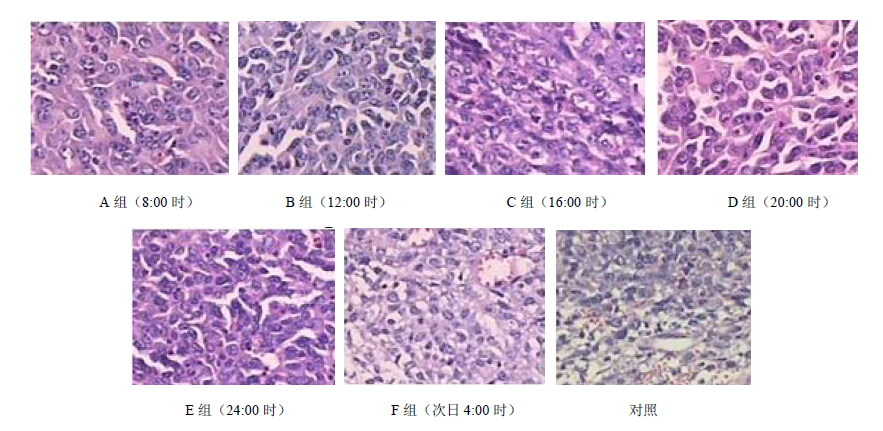 | 图 2 C57BL/6荷瘤小鼠肿瘤组织病理切片图(HE染色×400)Fig. 2 Histopathological observation of tumor in C57BL/6 mice (HE staining, ×400) |
对照组的皮肤组织细胞正常,由于吉非替尼的影响实验组和对照组皮肤组织细胞明显不同,对照组的细胞表面光滑,细胞形状规则,表面无纤维化物质,不同实验组受吉非替尼影响不同,以A组影响最轻,细胞表面出现了少许纤维化物质;B、C、D、E组皮肤损伤,失水较为严重,大量的纤维化物质覆盖于细胞表面,以C组最为严重,F组的纤维化程度位于A组和其他实验组之间。见图 3。
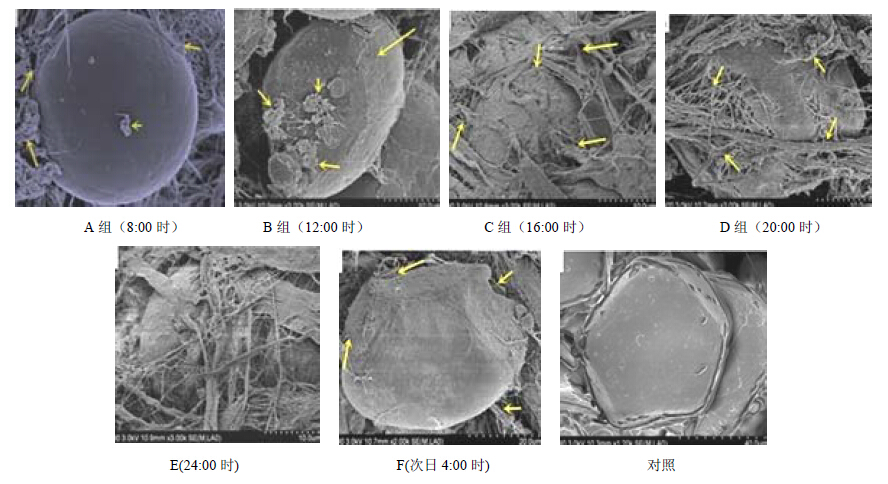 | 图 3 扫描电镜观察荷瘤小鼠的皮肤细胞Fig. 3 Observation of skin cells in tumor bearing mice by SEM |
为了对比吉非替尼按时辰给药对荷瘤小鼠腹泻的影响,以小鼠的肛周红肿和血清中IL-6水平为指标,见表 2。
| 表 2 荷瘤小鼠的肛周红肿率和血液中IL-6水平比较(x±s,n=8) Table 2 Comparison on perianal swelling and IL-6 levels(x±s,n=8) in blood of tumor-bearing mice |
不同实验组肛周红肿的比率有一定的差异,以A组的最低(25%),D组的比率最高(62.5%)。IL-6水平与小鼠肛周红肿的比例基本一致,对照组的分泌较少,与其他实验组相比,A组血清中IL-6的含量最低(P<0.05)。
4 讨论在过去的十几年中,吉非替尼作为第1个上市的小分子靶向药物一直用于晚期非小细胞肺癌的治疗,随着对该肿瘤的相关基因蛋白的研究,该药的疗效逐渐得到了改善。该药治疗非小细胞肺癌的机制主要为竞争性结合EGFR-TK催化区域的镁-三磷酸腺苷(Mg-ATP)结合位点,阻断蛋白激酶的自身磷酸化和底物的磷酸化,进而阻断EGFR信号转导通路,最终导致肿瘤细胞死亡。
时辰药理学是近年来新兴的学科,其研究基础是生物节律性,为临床使用高效低毒的给药方案提供了广阔的平台。个体化用药和联合用药是以后肿瘤治疗的发展趋势,时辰化疗在肿瘤的临床治疗中受到越来越多的重视,其目标为提高肿瘤患者对化疗药物的耐受性,提高抗肿瘤疗效。时辰给药方法的建立主要基于以下两点:首先,宿主敏感性最高时应当尽量减少或避免抗肿瘤药物的摄入;其次,宿主敏感性最低时且肿瘤细胞作用靶点活性最高时给药。本研究为吉非替尼在时辰药理学领域的探讨,给药时间设计为8:00、12:00、16:00、20:00、24:00以及次日凌晨4:00时。不同时间给药后,记录荷瘤小鼠的生活状态和肿瘤体积。结果表明吉非替尼对肺癌小鼠的抗肿瘤作用存在一定的节律性,以8:00最优,次日凌晨4:00时次之,16:00—20:00疗效相近,以16:00时相对较差。
长期给药吉非替尼对模型小鼠的生存质量也有一定的影响,以A组和F组的小鼠行动相对活跃,反应灵敏,毛色也较为鲜亮,说明对小鼠的生存质量影响较小。尽管吉非替尼没有常见化疗药所导致的不良反应,如细胞毒性、血液毒性等,但是该药所导致的皮肤毒性在临床上发生率极高,直接影响了患者的依从性和生存质量[14]。实验采用扫描电镜观察不同时间给药对皮肤组织的损伤,结果A组的皮肤损伤相对较轻,与其他实验组比较,该组皮肤细胞形状规则、失水少、细胞表面光滑、纤维化物质也较少,从F组到B、D、E、C组损伤情况依次加重。
腹泻也是吉非替尼常见不良反应之一[15],通过记录实验组小鼠的肛周红肿发生率和细胞因子IL-6衡量不同组给药对腹泻的影响。有研究发现,IL-6在胃肠道中起着非常重要的作用[16]。当胃肠道失衡时,尤其是腹内的IL-6明显升高,调节对疾病的生理反应[17]。A组小鼠发生肛周红肿的比率很低(25%),而IL-6的分泌也最接近对照组(38.24 pg/mL),D组的最高(196.18 pg/mL)。说明与其他实验组相比,A组和F组对小鼠胃肠道毒性作用较小。
目前时辰化疗药物研究多集中于高细胞毒性抗肿瘤药,吉非替尼的时辰药理学研究很少。其机制有待深入研究,疗效呈现出节律性可能有两个原因,一方面可能是由于信号转导通路中表皮生长因子酪氨酸激酶(EGFR-TK)呈节律性表达,另一方面可能是由于睡眠早期(上午)和活动晚期(凌晨)其代谢酶cpy3a11、cyp3a13和cyp1a2的活性减弱,睡眠晚期和活动早期,其代谢酶活性增强,使药物代谢加快、作用时间减少,进而影响了其抗肿瘤作用。
总之,吉非替尼在肺癌小鼠模型上的抗肿瘤作用和毒副作用存在一定的节律性,本研究结果将有利于优化吉非替尼的给药模式,并为进一步的临床试验提供参考依据。
| [1] | Parkin D M, Bray F, Ferlay J. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74-108. |
| [2] | Gandara D, Narayan S, Lara PN Jr, et al. Integration of novel therapeutics into combined modality therapy of locally advanced non-small cell lung cancer[J]. Clin Cancer Res, 2005, 11(13): 5057-5062. |
| [3] | Jorissen R N, Walker F, Pouliot N, et al. Epidermal growth factor receptor mechanisms of activation and signaling[J]. Exp Cell Res, 2003, 284(1): 31-53. |
| [4] | Kim E S, Hirsh V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomized phase III trial[J]. Lancet, 2008, 372(9652): 1809-18. |
| [5] | Okamura H. clock genes in cell clocks:roles, actions, and mysteries[J]. J Biol Rhythms, 2004, 19(5): 388-399. |
| [6] | Bartness T J, Song C K, Demas G E, et al. SCN efferents to peripheral tissues: implications for biological rhythms[J]. J Biol Rhythms, 2001, 16(3): 196-204. |
| [7] | Panda S, Hogenesch J B. It is all in the timing many clocks many outputs[J]. J Biol Rhythms, 2004, 19(5): 374-387. |
| [8] | Sahar S, Sassone-Corsi P. Metabolism and cancer: the circadian clock connection[J]. Nat Rev Cancer, 2009, 9(12): 886-896. |
| [9] | Filipski E, Lévi F. Circadian disruption in experimental cancer processes[J]. Integr Cancer Ther, 2009, 8(4): 298-302. |
| [10] | Abolmaali K, Balakrishnan A. Circadian variation in intestinal dihydropyrimidine dehydrogenase (DPD) expression: a potential mechanism for benefits of 5FU chrono-chemotherapy[J]. Surgery, 2009, 146(2): 269-273. |
| [11] | Arif I S, Hooper C L, Greco F, et al. Increasing doxorubicin activity against breast cancer cells using PPARγ-ligands and by exploiting circadian rhythms[J]. Br J Pharmacol, 2013, 169(5): 1178-1188. |
| [12] | Yang K, Zhao N, Zhao D, et al. The drug efficacy and adverse reactions in a mouse model of oral squamous cell carcinoma treated with oxaliplatin at different time points during a day[J]. Drug Des Devel Ther, 2013, 7: 511-517. |
| [13] | Chen S C, Chien Y C, Pan C H, et al. Inhibitory effect of dihydroaustrasulfone alcohol on the migration of human non-small cell lung carcinoma A549 cells and the antitumor effect on a Lewis lung carcinoma-bearing tumor model in C57BL/6J mice[J]. Mar Drugs, 2014, 12(1): 196-213. |
| [14] | Lee K H, Lee K Y, Jeon Y J, et al. Gefitinib in Selected Patients with Pre-Treated Non-Small-Cell Lung Cancer: Results from a Phase IV, Multicenter, Non-Randomized Study (SELINE)[J]. Tuberc Respir Dis (Seoul), 2012, 73(6): 303-311. |
| [15] | Cohen M H, Williams G A, Sridhara R, et al. United States Food and Drug Administration Drug Approval summary: Gefitinib (ZD1839; Iressa) tablets[J]. Clin Cancer Res, 2004, 10(4): 1212-1218. |
| [16] | Groblewska M, Mroczko B, Wereszczyńska-Siemiatkowska U, et al. Serum interleukin 6 (IL-6) and C-reactive protein (CRP) levels in colorectal adenoma and cancer patients[J]. Clin Chem Lab Med, 2008, 46(10): 1423-1428. |
| [17] | O'Malley D, Dinan T G, Cryan J F. Interleukin-6 modulates colonic transepithelial ion transport in the stress-sensitive wistar kyoto rat[J]. Front Pharmacol, 2012, 3: 190. |
 2014, Vol. 29
2014, Vol. 29



