2. 沈阳药科大学, 辽宁 沈阳 110016
2. Shenyang Pharmaceutical University, Shenyang 110016, China
人参皂苷是人参属植物人参、西洋参和三七等植物中的主要有效成分。其基本骨架见图 1。现代药理学研究表明,人参皂苷具有极强的抗肿瘤、抗炎、抗氧化等药理活性[1]。人参皂苷中Rb1、Rd、Re等含量较高,而化合物K、Rg3、Rh2、Rh3等人参皂苷含量较少,为稀有人参皂苷,现代药理学研究表明其都具有极强的抗肿瘤作用[2, 3, 4, 5, 6, 7]。同时有研究表明,口服人参以后,主要人参皂苷在人的消化系统中被转化成稀有人参皂苷后吸收起药效[8],但因含量稀少大大限制了其应用,因此制备稀有人参皂苷具有重要意义[9]。获得大量、高纯度的稀有人参皂苷,并开发成可用于临床防治肿瘤的制剂将具有重要的科研意义和社会价值,这将对先导化合物的发现和创新药物研究具有重要意义。
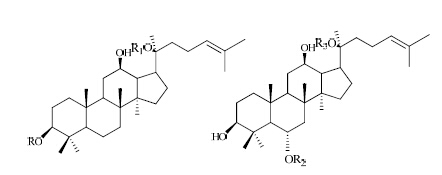 | 图 1 人参皂苷的化学结构Fig. 1 Chemical structures of ginsenoside |
用于人参皂苷糖苷化合成的方法主要有化学合成法、酶解法和微生物转化法。虽然酶解法和微生物转化法具有区域和立体选择性好、反应温和等优点,但反应所需的糖基转移酶比较昂贵[10],对底物的专一性要求较高,且酶对底物的接受条件比较苛刻。因此,糖的化学合成不可或缺。
1 化学合成法在糖的合成化学中,糖苷化反应是最基本的反应。传统的糖苷化反应是将一个糖的异头位衍生得到糖苷化给体与具有裸露羟基的底物称为受体,经过糖苷化反应形成缩醛键连接起来,形成一个新的糖苷键,见图 2。糖苷化反应主要涉及到区域选择性、立体选择性和收率,影响糖苷化反应的因素很多,其中给体、受体和促进剂是3个主要因素,其他反应条件如溶剂、温度和浓度等对其都有影响。
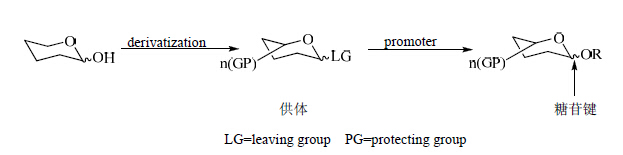 | 图 2 糖苷化反应示意图Fig. 2 Reaction scheme of glycosylation |
相对蛋白质和核酸化学,糖化学起步较晚,自1902年Koenigs-Knorr反应的创立,到目前为止已经形成了20多种糖苷化方法,1991年Mukaiyama等[11]以乙酰酯基做为离去基团,以CaCl2-AgClO4做为催化剂成功地进行了糖苷化反应,得到了目标产物。1992年Li等[12]用三氯乙酰脂基代替乙酰脂基成功的进行了糖苷化反应,使反应的收率变的更高、立体选择性变的更好。以及后来所发展的三氯乙酰亚胺脂是现阶段糖苷化反应应用最为普遍的糖苷化方法。伴随着糖苷化方法的发展,反应中所需的催化剂也发生了巨大的发展,常见的催化剂有PPh3AuNTf2,路易斯酸TMSOTf和N-碘代丁二酰亚胺-三氟甲磺酸银混合物,银的氧化物Ag2CO3、Ag2O,固体酸Amberlyst-15、NKC-9和Nafion-H等。下面以催化剂的种类不同为思路对现有糖苷化方法进行总结。
1.1 PPh3AuNTf2为催化剂牛一鸣[13]用PPh3AuNTf2为催化剂,邻炔基苯甲酸为糖基给体,以定向保护不反应基团为思路,成功制得了人参皂苷Fl、F3、L10等。合成路线见图 3~5。
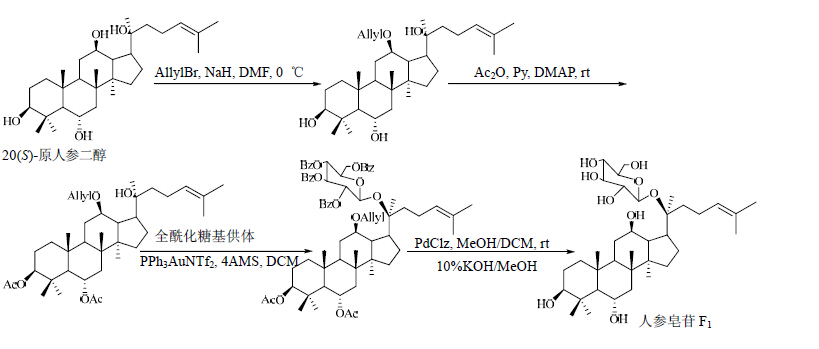 | 图 3 人参皂苷F1的合成路线Fig. 3 Synthetic route of ginsenoside F1 |
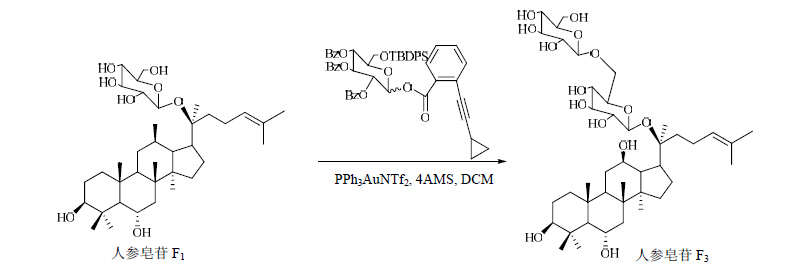 | 图 4 人参皂苷F3的合成路线Fig. 4 Synthetic route of ginsenoside F3 |
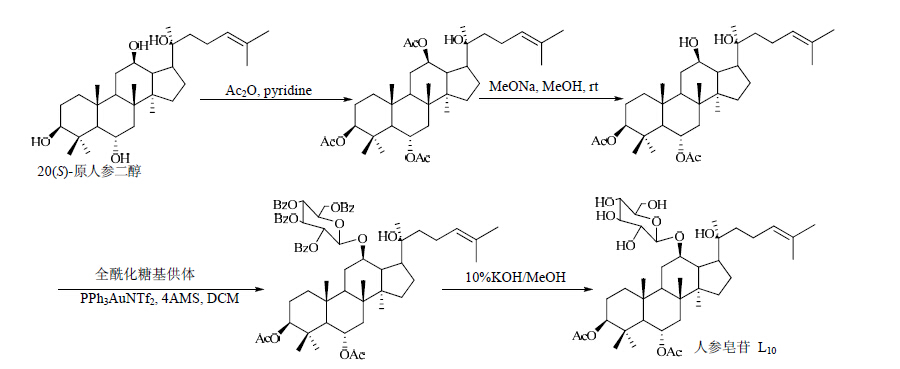 | 图 5 人参皂苷L10的合成路线Fig. 5 Synthetic route of ginsenoside L10 |
相对于底物原人参二醇,该课题组所合成的几个稀有人参皂苷F1、F3、L10都具有极强的药理活性,冯志霞等[14]研究发现其中人参皂苷F1、F3对脑缺血具有极强的缓解作用。Liao等[15]以原人二醇为底物,以相同的方法顺利得到了人参皂苷Rh2,相对于其他方法的糖苷化反应,该方法的优点是有效的克服了人参三醇中20位对酸的敏感性以及大位阻叔羟基的影响,并且反应具有极高的收率。合成路线见图 6。
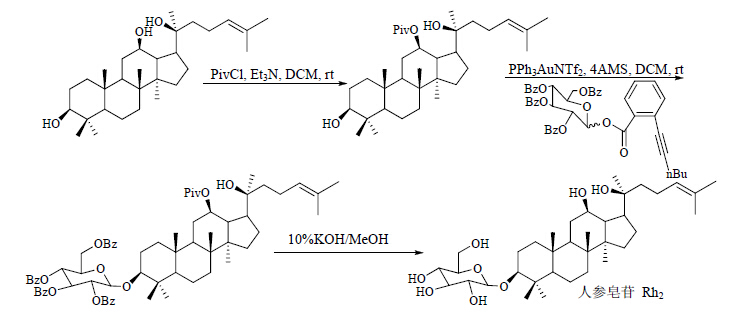 | 图 6 人参皂苷Rh2的合成路线Fig. 6 Synthetic route of ginsenoside Rh2 |
现代药理学研究表明,相对于底物原人参二醇,产物人参皂苷Rh2能够有效地促进人肺腺癌细胞凋亡并且抑制其增殖[16],抑制卵巢癌细胞的增殖[17]。
1.2 TMSOTf作为催化剂邢瑞[18]、惠永正等[19]、奕德刚等[20, 21],分别以新人参二醇和原人参二醇为底物,TMSOTf为催化剂,全乙酰化的三氯乙酰亚氨酯葡萄糖为糖供体,进行糖苷化反应,成功得到了新人参二醇皂苷、20(S)-人参皂苷Rh2、20(R)-人参皂苷Rh2和人参皂苷Rh3。合成路线见图 7~10。
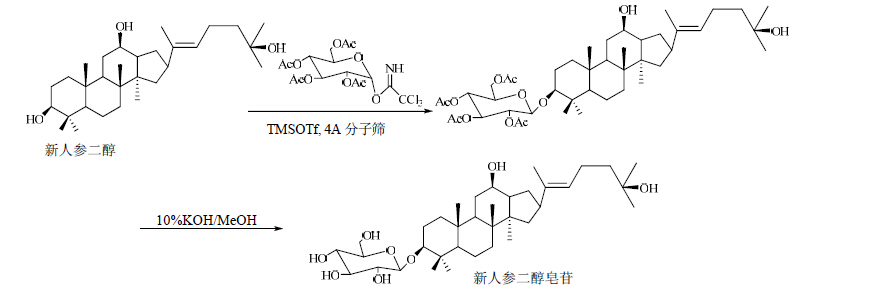 | 图 7 新人参二醇皂苷的合成路线Fig. 7 Synthetic route of new ginseng diolsaponin |
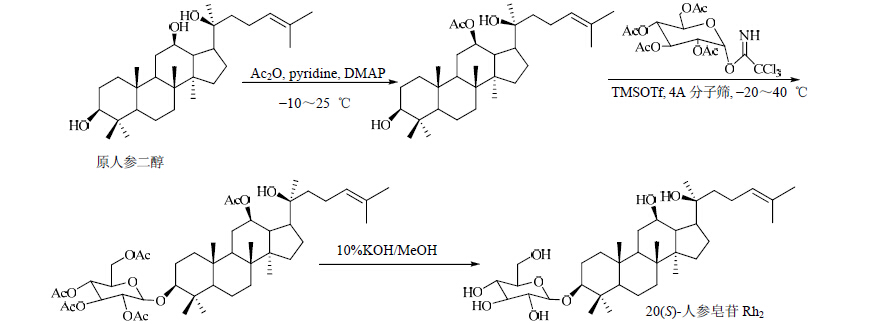 | 图 8 20(S)-人参皂苷Rh2的合成路线Fig. 8 Synthetic route of 20(S)-ginsenosideRh2 |
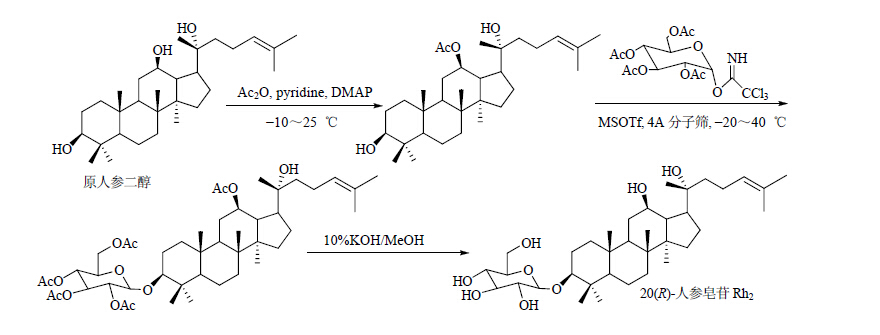 | 图 9 20(R)-人参皂苷Rh2的合成路线Fig. 9 Synthetic route of 20(R)-ginsenosideRh2 |
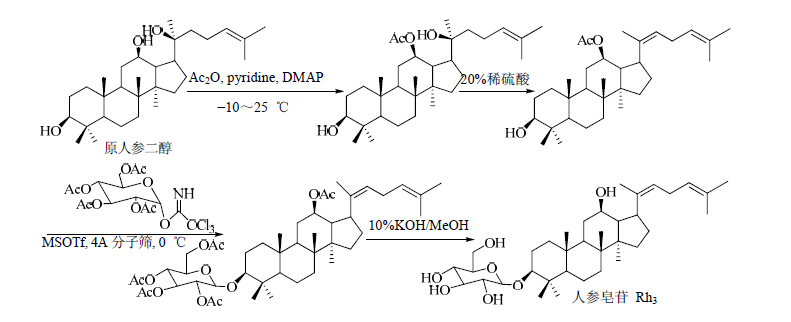 | 图 10 人参皂苷Rh3的合成路线Fig. 10 10 Synthetic route of ginsenoside Rh3 |
TMSOTf催化剂,虽然存在价格昂贵等缺点,但是适用于大部分的糖苷化反应,而且具有对反应物转化率高等优点。三氯乙酰亚氨脂是Schmidt等[22]在1980年发展出来的,其作为糖基供体具有制备方便、普适性好、促进催化、反应条件温和等优点。
通过糖苷化反应在新人参二醇的3位成功连接一个葡萄糖基,明显改变了原有化合物的药理活性以及在体内的代谢稳定性。糖苷化反应合成的人参皂苷Rh3相对于原人参二醇药理活性明显增强。
1.3 Ag2CO3或Ag2O作为催化剂Anufriev等[23]、刘惟瑳等[24]和Schneider等[25],分别以12位乙酰化的原人参二醇和人参二醇为底物,7-氧代-乙酰化-α-槐糖基溴和四乙酰溴代葡萄糖作为糖基供体,以Ag2CO3或Ag2O做为催化剂,成功得到人参皂苷Rg3、人参皂苷Rh2类似物Rh'2和化合物1。合成路线见图 11~13。
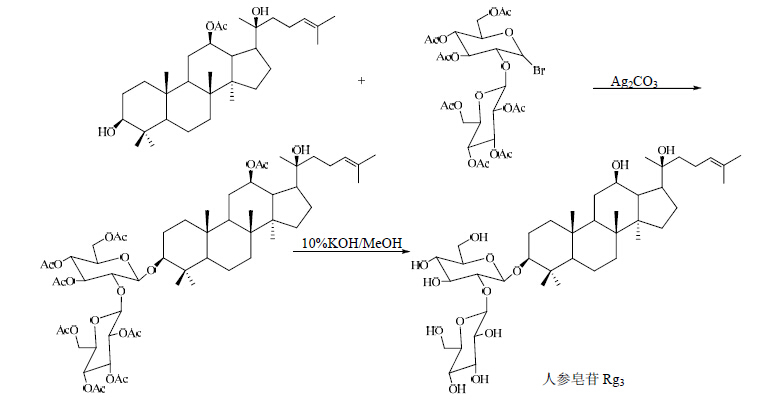 | 图 11 人参皂苷Rg3的合成路线Fig. 11 Synthetic route of ginsenoside Rg3 |
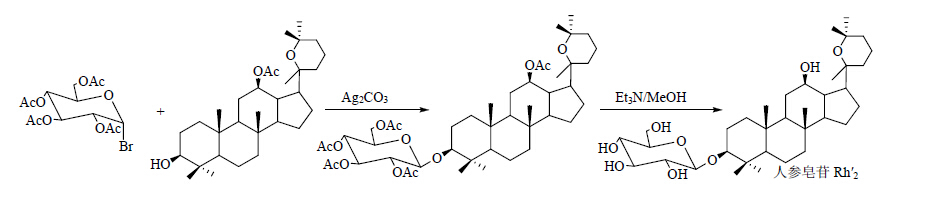 | 图 12 人参皂苷Rh′2的合成路线Fig. 12 Synthetic route of ginsenosideRh′2 |
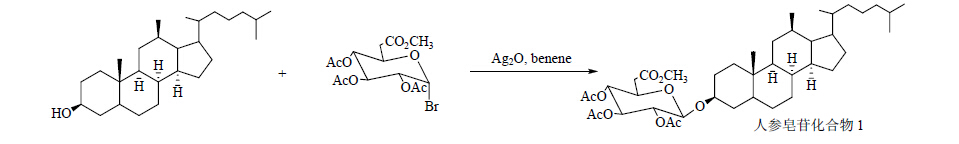 | 图 13 人参皂苷化合物1的合成路线Fig. 13 Synthetic route of ginsenoside compound 1 |
以Ag2CO3或者Ag2O为催化剂合成的人参皂苷Rg3相对于原人二醇具有极强的抗肿瘤作用,是上市药物参一胶囊中的主要成分,为广大癌症患者的康复带来了福音。
1.4 固体酸为催化剂奕德刚等[20, 21, 26]、以20(S)-原人参二醇、20(R)-原人参二醇和原人二醇为糖基受体,以固体酸做为催化剂,以全乙酰化的三氯乙酰亚氨酯葡萄糖作为糖基供体,分别通过对人参皂苷12位乙酰化进行保护,以及对原人参二醇20位的羟基在酸性条件下进行脱水,形成双键,成功得到了20(S)-人参皂苷Rh2、20(R)-人参皂苷Rh2和人参皂苷Rh3。合成路线见图 14~16。
 | 图 14 20(S)-人参皂苷Rh2的合成路线Fig. 14 Synthetic route of 20(S)-ginsenoside Rh2 |
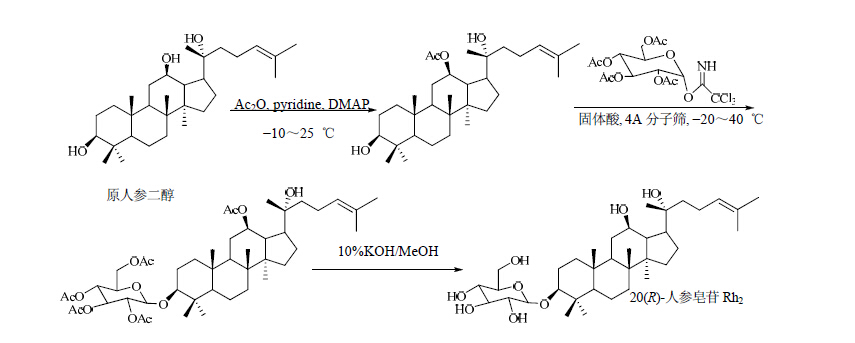 | 图 15 20-(R)-人参皂苷Rh2的合成路线Fig. 15 Synthetic route of 20(R)-ginsenoside Rh2 |
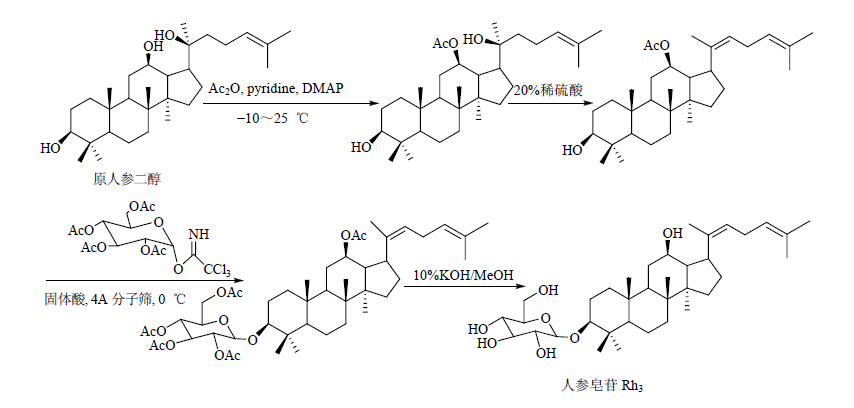 | 图 16 人参皂苷Rh3的合成路线 Fig. 16 Synthetic route of ginsenoside Rh3 |
相对于其他糖苷反应所选的催化剂如PPh3AuNTf2、Ag2CO3或Ag2O、路易斯酸TMSOTf等,该反应所选的催化剂固体酸具有绿色环保、价格低廉等特点,适合大规模工业化制备的选择。
2 酶解法化学合成法的反应条件复杂,产率低,对催化剂、反应温度等要求极高,这些都严重的制约了人参皂苷在工业上的放大合成。相对于化学合成法,Chung等[27]、Keegstra等[28]研究表明酶解法具有反应条件温和,对底物区域和立体选择性好等优点,酶解法的出现极大的弥补了化学合成的不足,糖基转移酶类普遍存在于植物体中,能够通过建立糖苷键将糖基连接到特定小分子化合物受体上,它们大多功能专一。糖基转移酶一般用核苷酸活化的糖做为糖基供体[29, 30, 31],通常是将活性糖残基从核苷糖,一般是从尿嘧啶核苷二磷酸-葡萄糖(UDP- glucose)转移到植物激素、次生代谢物等多种小分子化合物上,虽然尿苷二磷酸鼠李糖基转移酶(UDP-Rha)、尿苷二磷酸半乳糖基转移酶(UDP-Glc)、尿苷二磷酸木糖基转移酶(UDP-Xyl)和尿苷二磷酸葡萄糖醛酸基转移酶(UDP-GlcUA)都已经被证明参加了糖苷化反应[32, 33],但是常见的糖基转移酶是UDP-Glc,在植物中,对小分子化合物进行糖基化是一种普遍的生理现象,是植物维持代谢平衡的重要机制[34]。除此之外糖苷转移酶与其他酶一样都具有高度的立体选择专一性,即一种酶只能作用一种底物。
Jung等[35]报道了三萜苷元被糖基转移酶催化生成人参皂苷,对于原人参三醇则是在C-6、20位置上进行糖基化形成了原人参三醇型人参皂苷;而对于原人参二醇型骨架是在C-3、20的羟基位置进行了糖基化形成了原人参二醇型人参皂苷。陈欣等[36]首次从人参毛状根中提取分离了一种葡萄糖基转移酶,用聚丙烯酰胺凝胶电泳(SDS-PAGE)测定其相对分子质量为56.6,并对其酶学特征进行了初步研究。现阶段报道的一些酶转化法糖苷化实例见表 1。
| 表 1 酶解法糖苷化实例 Table 1 Examples of enzymatic glycosylation |
微生物转化合成法相对于化学合成法和酶解法具有反应条件温和,转化效率高,副产物少,产物接近天然,无环境污染等特点。由于通过微生物转化往往能得到化学合成难以获得的新颖结构,此技术在中药的研究和创新中已显得越来越重要[42]。
微生物转化法糖苷化实例见表 2。
| 表 2 微生物转化法糖苷化实例 Table 2 Examples of microbial transformation glycosylation |
本文介绍了最近十几年来合成稀有人参皂苷取得的一些成就,除了传统的化学合成法外,酶解法和微生物转化法被应用到这个领域中来,并取得了卓越的成果。采用酶解法和微生物转化法具有反应条件容易控制、酶系丰富、区域和立体选择性强等许多化学合成法所不具备的优点。因此在工业化大规模制备稀有人参皂苷时首选酶解法和微生物转化法,它们的应用使得稀有人参皂苷的大规模制备和工业化生产将指日可待,这将为先导化合物的发现和创新药物的研究提供有力的条件。
| [1] | 何道同, 王 兵, 陈珺明. 人参皂苷药理作用研究进展[J]. 辽宁中医药大学学报, 2012, 14(3): 118-121. |
| [2] | Xu T M, Xin Y, Cui M H, et al. Inhibitory effect of ginsenoside Rg3 combined with cyclophosphamide on growth and angiogenesis of ovarian cancer [J]. Chin Med J, 2007, 120(7): 584-588. |
| [3] | 张 荣,赵 翌,刘基巍, 等. 人参皂苷Rg3诱导小鼠肝癌细胞凋亡及抑制肿瘤血管内皮生长因子生成的研究 [J]. 时珍国医国药, 2007, 18(1): 130-133. |
| [4] | Li W, Liu Y, Zhang J W, et al. Anti-androgen-independent prostate cancer effects of ginsenometabolites in vitro: mechanism and possible structure-activity relationship investigation [J]. Arch Pharm Res, 2009, 32(1): 49-57. |
| [5] | Wakabayashi C, MuraKami K, Hasegawa H, et al. An intestinal bacterial metabolite of ginseng protopanaxadiol saponins has the ability toinduce apoptosis in tumor cells [J]. Biochem Biophys Res Commun, 1998, 246(3): 725-730. |
| [6] | 何 鑫. 人参皂苷Rh2对人肝癌Bel-7402细胞增殖和凋亡的影响 [D]. 长沙: 中南大学, 2012. |
| [7] | 程 慧, 宋新波, 张丽娟. 人参皂苷Rg3与Rh2的研究进展 [J]. 药物评价研究, 2010, 33(4): 307-311. |
| [8] | Hasegawa H, Sung J H, Matsumiyas S, et al. Main ginseng saponin metabolites formed by intestina bacteria [J]. Planta Med, 1996, 62(5): 453-457. |
| [9] | 崔玉娜, 张怡轩, 赵余庆. 利用生物转化法制备稀有人参皂苷的研究进展 [J]. 中草药, 2009, 40(5): 676-680. |
| [10] | 王 毅, 蒋 艳, 王本祥, 等. 人参皂苷Rg1及其肠内菌代谢产物Rh1对小鼠免疫细胞功能的影响 [J]. 药学学报, 2002, 37(12): 927-929. |
| [11] | MukaiyamaT, KatsuradaM, TakashimaT, et al. A highly stereoselective synthesis of α-glucosides from 1-O-acetyl glucose by use of Tin(IV) chloride-silver perchlorate catalyst system [J]. Chem Lett, 1991: 985. |
| [12] | Li Z J, Cai M S. Trichloroacetic ester base in the application of the glycosidic reaction [J]. Synth Commun, 1992, 22(21): 21. |
| [13] | 牛一鸣. 人参皂苷的高效合成 [D]. 郑州: 郑州大学, 2012. |
| [14] | 冯志霞, 张培旭, 陈嘉峰, 等. 人参皂苷F组对急性脑缺血大鼠细胞凋亡及VEGF表达的影响 [J]. 中风与神经疾病杂志, 2010, 27(2): 142-145. |
| [15] | Liao J X, Sun J S, Niu Y M, et al. Synthesis of ginsenoside Rh2 and chikusetsusaponin-LT8 via gold(I)-catalyzed glycosylation with a glycosyl ortho-alkynylbenzoate as donor [J]. Tetrahedron Lett, 2011, 52(24): 3075-3078. |
| [16] | 张悦萌. 人参皂苷Rh2对人肺腺癌细胞A549增殖和凋亡的影响 [D]. 延吉: 延边大学, 2012. |
| [17] | 黄运兰. 人参皂苷Rh2对人卵巢癌细胞的作用及其机制的研究 [D]. 长春: 吉林大学, 2012. |
| [18] | 邢 瑞. 人参根总皂苷的酸降解工艺及新人参二醇的糖苷化研究 [D]. 长春: 吉林大学, 2009. |
| [19] | 惠永正, 杨志奇, 刘俊耀, 等. 20(S)-人参皂苷Rh2的合成方法 [P]. 中国: CN200410053269.2, 2006-04-19. |
| [20] | 奕德刚, 邝志国, 蒋爱芳, 等. 20(R)-人参皂苷Rh2的合成方法 [P]. 中国: 201110081488.1, 2012-10-17. |
| [21] | 奕德刚, 郝少丽, 蒋爱芳, 等.人参皂苷Rh3的合成方法 [P]. 中国: 201010228202.3, 2012-02-01. |
| [22] | Schmidt R. Michel J. Facile synthesis of α-and β-O-glycosyl imidates; preparation of glycosides and disaccharides [J] Angew Chem Int Ed, 1980, 19(9): 731. |
| [23] | Anufriev V P, Malinovskaya G V, Denisenko V A, et al. Synthesis of ginsenoside Rg3, a minor constituent of Ginseng Radix [J]. Carbohydr Res, 1997, 304(2): 179-182. |
| [24] | 刘惟瑳, 陈英杰, 刘明生, 等. 人参皂苷Rh′2的半合成 [J]. 沈阳药学院学报, 1988, 34(1): 14-15. |
| [25] | Schneider J J, Bhacca N S. Synthesis and characterisation of cholesteryl β-D-glucuronide and derivatives [J]. J Org Chem, 1969, 34(6): 1990-1993. |
| [26] | 奕德刚, 郝少丽, 蒋爱芳, 等. 20(S)-人参皂苷Rh2的合成方法 [P]. 中国: 201010228174, 2012-02-01. |
| [27] | Chung H J, Kim Y A, Kim Y J, et al. Purifcation and characterization of UDP-glucose: tetrahydrobiopterin glucosyltransferase from Synechococcus sp. PCC 7942 [J]. Biochim Biophys Acta, 2000, 1524(2/3): 183-188. |
| [28] | Keegstra K, Raikhel N. Plant glycosyltransferases [J]. Curr Opin Plant Biol, 2001, 4(3): 219-224. |
| [29] | Chang A, Singh S, Phillips G N, et al. Glycosyl- transferase structural biology and its role in the design ofcatalysts for glycosylation [J]. Curr Opin Biotechnol, 2011, 22(6): 800-808. |
| [30] | Lim E K. Plant glycosyltransferases: their potential asnovel biocatalysts [J]. Chemistry, 2005, 11(19): 5486- 5494. |
| [31] | Bowles D, Isayenkova J, Lim E K, et al. Glycosyl- transferases: managers of small molecules [J]. Curr Opin Plant Biol, 2005, 8(3): 254-263. |
| [32] | Bowles D, Lim E K, Poppenberger B, et al. Glycosyl- transferases of lipophilic small molecules [J]. Annu Rev Plant Biol, 2006, 57: 567-597. |
| [33] | Ikan R. Naturally Occurring Glycosides [M]. New York: John Wiley and Sons, Inc, 1999, 444. |
| [34] | Weis M, Lim E K, Bruce N C, et al. Engineering and kinetic characterisation of two glucosyltransferases from Arabidopsis thaliana [J]. Biochimie, 2008, 90(5): 830-834. |
| [35] | Jung J D, Park H W, Hahn Y, et al. Discovery of genes for ginsenoside biosynthesis by analysis of ginseng expressed sequence tags [J]. Plant Cell Rep, 2003, 22(3): 224-230. |
| [36] | 陈 欣, 薛 轶, 刘吉华, 等. 人参毛状根糖基转移酶的分离纯化及酶学性质研究 [J]. 药物生物技术, 2009, 16(1): 50-54. |
| [37] | 何彦平. 尿苷二磷酸葡萄糖(UDPG): 人参皂苷Rh2葡萄糖基转移酶((UGRh2GT)的纯化与生化特性的研究 [D]. 大庆: 黑龙江八一农垦大学, 2010. |
| [38] | Yue C J, Zhong J J. Purification and characterization of UDPG: ginsenoside Rd glucosyltransferase from suspended cells of Panax notoginseng [J]. Proc Biochemistry, 2005, 40(12): 3742-3748. |
| [39] | Hou J G, Xue J J, Wang C Y, et al. Microbial transformation of ginsenoside Rg3 to ginsenoside Rh2 by Esteya vermicola CNU 120806 [J]. World J Microb Biot, 2012, 28(4): 1807-1811. |
| [40] | Sun C, Li Y, Wu Q, et al. De novo sequencing andanalysis of the American ginseng roottranscriptome using a GS FLX Titanium platform to discoverputative genes involved in ginsenoside biosynthesis [J]. BMC Genomics, 2010, 11: 262. |
| [41] | Danieli B, Falcone L, Monti D, et al. Regioselective enzymatic glycosylationof natural polyhydroxylated compounds: galactosylationand glucosylation of protopanaxatriol ginsenosides [J]. J Org Chem, 2001, 66(1): 262-269. |
| [42] | 阮晓东, 张惠文, 蔡颖慧, 等. 微生物在中药生物转化中的应用 [J]. 中草药, 2009, 40(1): 149-152. |
| [43] | Quan L H, Kim Y J, Li G H, et al. Microbial transformation of ginsenoside Rb1 to compound K by Lactobacillus paralimentarius [J]. World J Microbiol Biotechnol, 2013, 29(6): 1001-1007. |
| [44] | Hou J, Xue J, Wang C, et al. Microbial transformation of ginsenoside Rg3 to ginsenoside Rh2 by Esteya vermicola CNU 120806 [J]. World J Microbiol Biotechnol, 2012, 28(4): 1807-1811. |
| [45] | Liu L, Gu L J, Zhang D L, et al. Microbial conversion of rare ginsenoside Rf to 20(S)-protopanaxatriol by Aspergillus niger [J]. Biosic Biotechnol Biochen, 2010, 74(1): 96-100. |
| [46] | Chen G T, Yang M, Song Y, et al. Microbial transformation of ginsenoside Rb1 by Acremonium strictum [J]. Appl Microbiol Biotechnol, 2008, 77(6): 1345-1350. |
| [47] | Chen G, Yang M, Lu Z, et al. Microbial transformation of 20(S)-protopanaxatriol-type saponins by Absidia coerulea [J]. J Nat Prod, 2007, 70:1203-1206. |
| [48] | Chi H, Kim D H, Ji G E. Transformation of ginsenosides Rb2 and Rc from Panax ginseng by food microorganisms [J]. Biol Pharm Bull, 2005, 28(11): 2102-2105. |
 2014, Vol.
2014, Vol. 


