2. 新疆中药民族药研究所, 新疆 乌鲁木齐 830002
2. Xinjiang Institute of Chinese Medica and Ethnodrug, Urumqi 830002, China
两色金鸡菊Coreopsis tinctoria Nutt.又名雪菊、金钱菊、金鸡菊、蛇目菊,系菊科金鸡菊属的干燥头状花序,一年生草本,高30~100 cm。在北美大平原和南部各州常被称为“calliopsis”。1823年北美人Thomas Nuttall首次对其进行描述,两色金鸡菊是一个小的、无毛、具有芳香气味的一年生草本植物,叶对生,二回羽状全裂,裂片条形或条状披针形,全缘,头状花序,舌状花黄色,或片舌基部褐色,舌片倒卵形,筒状花红褐色,窄钟状,瘦果纺锤形,两面光滑或有突起,花期6~9月[1]。首次发现于美国低矮潮湿的地区,主要分布在中西部、南部、中大西洋沿岸各州,现世界范围内均有分布[2]。金鸡菊属植物约有100种,主要分布于美洲、非洲南部及夏威夷群岛等地,在我国常见金鸡菊属植物有两色金鸡菊C. tinctoria Nutt.、大花金鸡菊C. grandiflora Hogg.、金鸡菊C. drummondiiTorr. et Gray、大叶金鸡菊C. major Watt.、三叶金鸡菊C. tripteris Linn.、轮叶金鸡菊C. verticllata Linn.[3]。其中两色金鸡菊在新疆又称昆仑雪菊,自2004年和田地区开始有规模的种植两色金鸡菊以来新疆先后有20个县种植,仅2011年年产量达到3 000 t,面积达6.6×104 km2以上,从民间作为别样茶至今全国各地广为饮用,以和田地区质量为佳[3, 4]。
两色金鸡菊是一种养生、保健的天然植物,其味甘、性平,归肝、大肠经,具有清热解毒、化湿止痢之功效。土著印第安人用来治疗腹泻、内部疼痛、出血、催吐[5]。新疆维吾尔医院作为维药材应用,具有清热解毒、活血化瘀、和胃健脾、降血脂、软化血管等作用,对冠心病、高血脂、糖尿病等有特殊疗效[6]。在葡萄牙也有每天喝两杯热两色金鸡菊茶用于控制糖尿病的传统[7]。
1 化学成分1956年日本学者Shimokoriyama[8]首次对两色金鸡菊的化学成分进行了研究。后来很长一段时间国内外学者并未对两色金鸡菊的化学成分进行研究,直到2006年中国学者对两色金鸡菊花的甲醇提取物进行了研究。随后几年来国内外也有少量关于两色金鸡菊化学成分研究的报道。研究发现两色金鸡菊的化学成分主要包括糖类、黄酮类、皂苷类、有机酸、鞣质、挥发油或油脂类和酚性成分;可能含有香豆素或内酯、三萜类或载体氨基酸、多肽或蛋白质[9]。2013年新疆研究者对新疆产两色金鸡菊中绿原酸和总黄酮进行了测定,并建立了指纹图谱,由此可比较不同产地两色金鸡菊的有效成分,为其质量标准的建立奠定了基础[10]。
1.1 挥发性成分两色金鸡菊挥发油为棕黄色透明油状液体,具有特殊浓郁的芳香气味。研究者采用水蒸气蒸馏法,利用挥发油提取器对雪菊挥发油进行了提取。利用GC-MS联用技术对雪菊挥发油进行了分离、分析与鉴定,从中共检测出23个色谱峰,并初步鉴定了其中22个化合物,占挥发油总量的92.66%。从分析结果来看,质量分数较高的主要有苧稀(63.50%)、3-蒈稀(7.05%)、β-对繖花烃(5.23%)、姜烯(2.45%)等[11]。
1.2 黄酮类成分两色金鸡菊中富含黄酮类化合物,总黄酮高达14.25%;其结构母核包括查尔酮类、橙酮类、黄酮类、二氢黄酮类、黄酮醇和黄烷醇类。但目前从两色金鸡菊中仅分离得到25个黄酮类成分。
1.2.1 查尔酮和橙酮类目前从两色金鸡菊分离得到6个查尔酮和1个橙酮。早在1956年,日本学者Shimokoriyama首次对两色金鸡菊的头状花序中的化学成分进行了研究并分离到2个黄酮类化合物,分别鉴定为马里苷(1)和橙酮金鸡菊苷(2)[8]。此外还从该种鉴定出马里苷的糖苷配基奥卡宁(3)。近年来,我国学者从两色金鸡菊中分得1个新化合物奥卡宁-4′-O-β-(6′′-O-丙二酰基)-吡喃葡糖糖苷(4)和3个已知化合物马里苷、紫铆花素(5)和金鸡菊苷[12](6),结构见图 1。
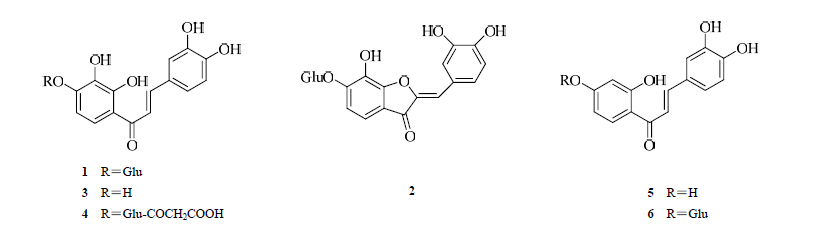 | 图 1 两色金鸡菊中查尔酮和橙酮类化合物结构Fig. 1 Structures of chalcones and aurone in C. tinctoria |
从两色金鸡菊中分离的二氢黄酮居多,共12个,主要有异奥卡宁7-O-β-吡喃葡萄糖苷(7)、(2R,3R)-二氢槲皮素-7-O-β-D-吡喃葡萄糖苷(8)、2S-3′,4′,7,8-四羟基二氢黄酮(9)、(2R,3R)- 3,3′,5,5′,7-五羟基二氢黄酮(10)、(2R,3R)-3,4′,5,6,7-五羟基二氢黄酮(11)、2S-3′,5,5′,7-四羟基二氢黄酮(12)、2S-3',5',7-三羟基二氢黄酮(13)、(2R,3R)- 3,4',5,7-四羟基二氢黄酮(14)[12, 13];3,4′,5,6,7-五羟基二氢黄酮-O-己糖苷(15)、3,3',5,5',7-五羟基二氢黄酮-O-己糖苷(16)、3',5,5',7-四羟基二氢黄酮-O-己糖苷(17)[14, 15]、8-羟基黄颜木素(18)[15],主要结构见图 2。
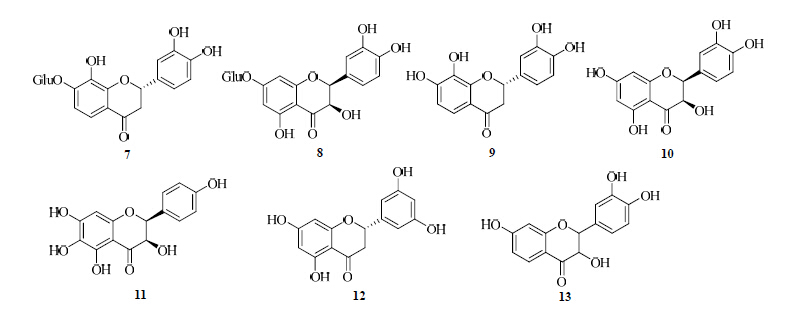 | 图 2 两色金鸡菊中黄酮和黄烷酮类化合物结构Fig. 2 Structures of flavonoids and flavanone in C. tinctoria |
1.2.3 黄酮醇和黄烷醇 Dias等[14]从两色金鸡菊的花中鉴定出黄酮醇类化合物槲皮素(19)、槲皮万寿菊素-7-O-β-吡喃葡萄糖苷/栎草亭-7-O-β-吡喃葡萄糖苷(20)。Abdureyim等[16]首次从两色金鸡菊的醋酸乙酯和正丁醇部位分离得到3个黄酮醇类化合物山柰酚-3-O-D-葡萄糖苷(21)、槲皮素-3-O-葡萄糖苷(22)、槲皮素-3-O-芸香糖苷(23)和1个黄烷醇类化合物儿茶素(24)。结构见图 3。
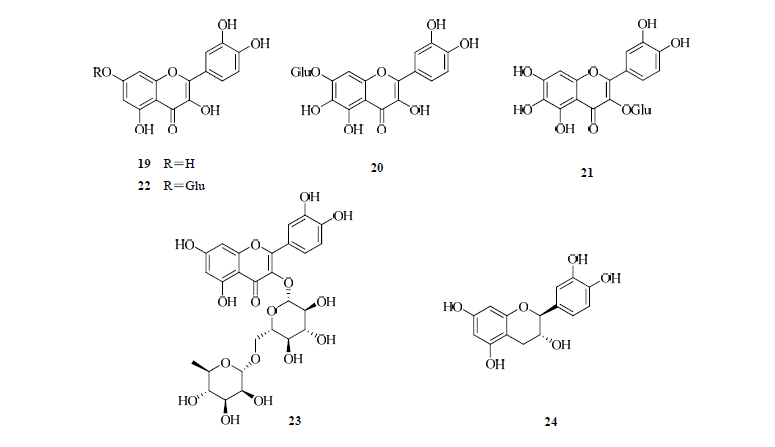 | 图 3 两色金鸡菊中黄酮醇和黄烷醇类化合物结构Fig. 3 Structures of flavonols and flavanols in C. tinctoria |
目前从两色金鸡菊中分离得到的苯丙素类化合物主要为苯丙酸,主要有1′-羟基-丁香油酚(25)、1′,2′-环氧基-Z-松柏基醇[17](26)、咖啡酸(27)、绿原酸(28)、1,3-二咖啡酰奎宁酸(29)[17]、4-异丁酰基-1′-乙酰氧基-丁香油酚(30)、4-异丁酰基-1′-异丁酰氧基-丁香油酚(31)、4-异丁酰基-1′-(2-甲基)-丁酰氧基-丁香油酚(32)、4-异丁酰基-1′-异戊酰氧基-丁香油酚(33)、4-异丁酰氧基-1′,2′-环氧基-3′-异丁酰氧基-松柏醇(34)[17, 18]和对羟基桂皮酸甲酯葡萄糖苷(35)[19],两色金鸡菊中苯丙素类化合物结构见图 4。
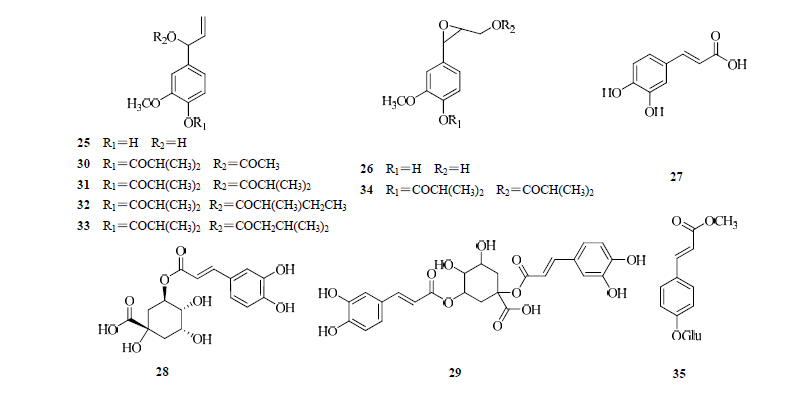 | 图 4 两色金鸡菊中苯丙素类化合物结构Fig. 4 Structures of phenylpropanoids in C. tinctoria |
张媛等[13]从两色金鸡菊中分离鉴定出2个甾醇类成分,分别为豆甾醇葡萄糖苷(36)和β-谷甾醇(37)。另外两色金鸡菊中还含有17种氨基酸,总量达10.80%,其中8种为人体必需氨基酸,占氨基酸总量的40.30%[20];总皂苷为8.40%[21],总多糖为13.9%[22]。
2 药理活性两色金鸡菊其头状花序在维吾尔族民间被用来预防心血管疾病,维语称其为“古里恰依”。两色金鸡菊具有清热解毒、活血化瘀之功效,维吾尔族人民将其用于高血压、痢疾、心慌等病症的治疗。关于两色金鸡菊现代药效、药理学的研究已初步开展,主要集中于降血糖、抗氧化、降血压、降血脂等方面[6]。
2.1 降血糖作用葡萄牙学者Dias等[23]用单一的ip链脲霉素(40 mg/kg)作为葡萄糖非耐受鼠模型,测定两色金鸡菊中黄酮的降血糖活性,发现ig治疗3周后大鼠体内的葡萄糖耐受性迅速恢复,且该提取物不会引起肝毒性,对大鼠的正常葡萄糖稳态和胰腺功能无影响。且两色金鸡菊提取物对鼠胰岛瘤MIN6细胞分泌胰岛素也没有影响。用1,1-二苯基-2-三硝基苯肼(DPPH)法评估自由基清除能力,发现两色金鸡菊提取物具有较好的自由基清除能力,EC50值为21 μg/mL。每日ig两色金鸡菊提取物500 mg/kg,3周后能够破坏链脲霉素诱导葡萄糖非耐受大鼠模型,并非通过诱导胰岛素分泌的机制。因为两色金鸡菊提取物具有良好的清除自由基能力,因此推测可能是两色金鸡菊提取物介导抗氧化机制从而使β-胰腺细胞功能得以恢复。随后,对两色金鸡菊降糖物质基础进一步研究,发现葡萄糖耐受性恢复是由于两色金鸡菊提取物中所有多酚类共同起作用,而非主要黄酮类成分马里苷单独起作用的结果。而且研究还显示ig两色金鸡菊提取物后葡萄糖耐受量的恢复确实部分是由于胰脏功能的恢复[14]。2012年,Dias等[24]利用两色金鸡菊水提取物、醋酸乙酯部位、马里苷和预处理MIN6胰岛瘤细胞,然后用tBPH和细胞因子诱导损伤来研究抑制细胞凋亡的机制。结果表明,两色金鸡菊提取物及单体化合物保护MIN6细胞是通过抑制凋亡信号级联,而非降低超氧化物自由基产生。
张淑鹏等[25]采用α-葡萄糖苷酶体外活性抑制模型,研究两色金鸡菊水和乙醇提取法制得的5种提取物对α-葡萄糖苷酶的抑制作用,结果发现5种提取物抑制活性均高于阿卡波糖。张燕等[26]亦采用α-葡萄糖苷酶体外活性抑制模型,发现水提法和有机溶剂萃取法制备的两色金鸡菊醋酸乙酯、正丁醇、总黄酮、水提物和中性黄酮对α-葡萄糖苷酶均有抑制作用,除水提物外抑制活性均高于阿卡波糖。
2.2 抗氧化作用韩国学者研究发现两色金鸡菊醋酸乙酯部位具有较强的清除DPPH、ABTS自由基的能力,IC50值为0.100 mg/mL[27, 28]。我国学者研究发现30%乙醇提取物和50%乙醇提取物清除羟基自由基的能力与维生素C相当;当两色金鸡菊提取物质量浓度为0.2~1.0 mg/mL时,随着溶液质量浓度的增加,对超氧阴离子自由基的清除作用也增加;当质量浓度达到1.0 g/L时,30%乙醇提取物和50%乙醇提取物对超氧阴离子自由基的清除率分别为55.7%、97.9%;30%、50%、70%乙醇提取物在质量浓度为1.0 mg/mL时,对DPPH自由基的清除率均超过了70.0%[ 29]。研究者采用50%乙醇微波辅助提取金鸡菊黄色素,对其抗氧化活性研究发现金鸡菊黄色素具有较强的抗杏仁油的过氧化作用,对羟基、DPPH自由基有清除作用,随溶液浓度的增加,清除能力逐渐增强,提示金鸡菊黄色素具有很好的抗氧化性[30]。
2.3 降血压作用用低温、高盐的方法建立小鼠高血压模型,连续给药28 d后,两色金鸡菊提取物50%乙醇洗脱物低、高剂量组均可显著降低小鼠血压,增强机体超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力及总抗氧化能力,而高剂量组可显著降低机体丙二醛(MDA)含量,表明两色金鸡菊提取物具有显著的降压作用和抗氧化功能。由此推断,两色金鸡菊对高血压造成的血管与脏器的损伤有一定程度地改善的作用,其作用途径可能是通过提高机体抗氧化能力,修复由高血压引起的过氧化、血管和脏器损伤,因此提高机体抗氧化能力是两色金鸡菊发挥降压作用的途径之一[31]。梁淑红等[32]采用大鼠体外胸主动脉血管环标本研究发现,两色金鸡菊提取物具有舒张血管、降血压的作用。其不同溶剂提取物对氯化钾预收缩的血管环均有不同程度的舒张作用,其中氯仿和醋酸乙酯部位舒张作用较为明显,在终质量浓度为3.0 mg/mL时舒张率分别可达到115.20%、103.50%。同样采用上述方法,研究者发现两色金鸡菊70%乙醇洗脱物在终质量浓度为3.0 mg/mL时对氯化钾预收缩内皮完整和去内皮血管环的舒张率分别为110.81%、125.14%,对苯肾上腺素预收缩无内皮血管环的舒张率为191.47%,表明两色金鸡菊提取物有舒张血管的作用[33]。用肾性高血压大鼠为模型,大鼠ig两色金鸡菊提取物28 d后发现,两色金鸡菊提取物在40、80、160 mg/kg均可显著降低肾性高血压大鼠 的血压、血浆血管紧张素Ⅱ(AngⅡ)、醛固酮、内皮素、主动脉组织中AngⅡ含量,明显升高血清NO水平和左肾重与右肾重的比值。由此可以推测其降压机制可能通过影响肾素-血管紧张素-醛固酮系统发挥类似血管紧张素转化酶抑制剂作用,而且参与内皮因子的调节[34, 35]。
2.4 降血脂作用利用高血脂模型小鼠研究两色金鸡菊总提物、氯仿、醋酸乙酯及正丁醇萃取部位的降血脂效果,研究发现,模型组小鼠血清总胆固醇(TC)、三酰甘油(TG)的含量明显升高,高密度脂蛋白胆固醇(HDL-C)明显降低;与模型组比较给予两色金鸡菊组(1.2 g/kg),总提取物组TC降低,HDL-C升高,氯仿组和醋酸乙酯组TC、TG明显降低,而HDL-C显著升高,正丁醇组TC、TG均显著降低。以上研究表明,金鸡菊提取物有较好的降血脂作用,值得进一步开发研究[36]。
2.5 其他作用两色金鸡菊黄色素主要是黄酮类化合物,也有研究报道黄酮及异黄酮可以抑制肠道内胆固醇的吸收,黄酮还可以降低血液黏度,强化毛细血管,改善心脏、肝脏功能[32, 37]。两色金鸡菊提取物富含黄酮的部位能明显的抑制高浓度钾离子和苯肾上腺素诱导的大鼠胸主动脉的收缩,这种作用可能与抑制钙离子通过细胞膜运转有关[38]。另外,两色金鸡菊乙醇提取物、氯仿、醋酸乙酯部位均有血管紧张素转换酶(ACE)、硝酸盐合成、放射扩散的抑制效果,且呈剂量相关性;各部位均具有抑制结肠癌HCT-116细胞株的作用,且呈现剂量相关性[27]。
3 结语原产于北美的两色金鸡菊,在我国引种成功后,具有广泛的适应性。作为药食兼用品种,在北美印第安人、葡萄牙人应用历史悠久。而作为茶饮应该首先起源于我国新疆和田地区,该地区维吾尔族利用玫瑰花、洋甘菊等泡茶有良好的基础。而两色金鸡菊在和田克里阳乡出现后,各族群众泡茶饮用也就顺理成章。综合观察近年的研究进展,其降血糖、抗氧化、降血压、降血脂作用值得关注。近年来,国内外对两色金鸡菊的化学成分、药理作用研究已从最初的提取物研究阶段深入到具体的单体成分研究,为阐明两色金鸡菊生物活性物质基础奠定了一定的基础。但对其降“三高”作用等重要药理活性的研究还不够深入,尚需通过系统而深入的药效和毒性评价,以进一步评估其开发利用价值。而对两色金鸡菊主要化学成分进行结构修饰及优化研究,获得活性与构效关系的规律,将为降“三高”候选药物的发现奠定基础。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 第75卷. 北京: 科学出版社, 1979: 365. |
| [2] | Dias T. Phytochemical study of Coreopsis tinctoria and evaluation of its antidiabetic properties [D]. Lisbon: University of Lisbon, 2011. |
| [3] | 米吉提, 胡达拜尔地, 徐建国. 新疆高等植物科属检索表 [M]. 乌鲁木齐: 新疆大学出版社, 2000. |
| [4] | 陈安新. 中国雪菊 [M]. 乌鲁木齐: 新疆美术摄影出版社, 2013, 12-15. |
| [5] | Foster S, Duke J A. A Field Guide to Medicinal Plants: Eastern and Central North America [M]. Boston: Houghton Mifflin Co, 1990. |
| [6] | 刘伟新, 邓继华, 徐 鸿. 一种金鸡菊花的生药学研究 [J]. 中国民族医药杂志, 2009(1): 24-25. |
| [7] | D Oliveira Feijao. Medicina Pelas Plantas [M]. Sixth Edition. Lisboa: Livraria Progresso Editora, 1973: 19. |
| [8] | Shimokoriyama M. Anthochlor pigments of Coreopsis tinctoria [J]. J Am Chem Soc, 1957, 79(1): 214-220. |
| [9] | 张彦丽. 新疆昆仑雪菊化学成分基础研究及其总黄酮提取工艺的筛选 [D]. 乌鲁木齐: 新疆医科大学, 2012. |
| [10] | 古扎力努尔·艾尔肯, 李新霞, 毛新民, 等. 新疆两色金鸡菊中绿原酸与总黄酮含量测定及指纹图谱的建立 [J]. 西北药学杂志, 2013, 28(3): 248-251. |
| [11] | 张彦丽, 韩艳春, 阿依吐伦·斯马义. GC-MS对昆仑雪菊挥发油成分的研究 [J]. 新疆医科大学学报, 2010, 33(11): 1299-1300. |
| [12] | Zhang Y, Shi S, Zhao M, et al. A novel chalcone from Coreopsis tinctoria Nutt [J]. Biochem Syst Ecol, 2006, 34(10): 766-769. |
| [13] | 张 媛, 屠鹏飞. 两色金鸡菊头状花序的化学成分研究 [J]. 中国中药杂志, 2012, 37(23): 3581-3584. |
| [14] | Dias T, Bronze M R, Houghton P J, et al. The flavonoid- rich fraction of Coreopsis tinctoria promotes glucose tolerance regain through pancreatic function recovery in streptozotocin-induced glucose-intolerant rats [J]. J Ethnopharmacol, 2010, 132(2): 483-490. |
| [15] | 赵 军, 孙玉华, 徐 芳, 等. 昆仑雪菊黄酮类成分研究 [J]. 天然产物研究与开发, 2013, 25(1): 50-52. |
| [16] | Abdureyim A, Abliz M, Sultan A, et al. Phenolic compounds from the flowers of Coreopsis tinctoria [J]. Chem Nat Compd, 2013, 48(6): 1085-1086. |
| [17] | Reichling J, Thron U. Comparative study on the production and accumulation of unusual phenylpropanoids in plants andin vitro cultures of Coreopsis tinctoria and C. lanceolata [J]. Pharmaceutisch Weekblad, 1989, 11(3): 83-86. |
| [18] | Reichling J, Thron U. Accumulation of rare phenylpropanoids in agrobacterium rhizogenes transformed toot cultures of Coreopsis tinctoria [J]. Planta Med, 1990, 56(5): 488- 490. |
| [19] | Zhang Y, Shi S, Zhao M, et al. Coreosides A-D, C14- polyacetylene glycosides from the capitula of Coreopsis tinctoria and its anti-inflammatory activity against COX-2 [J]. Fitoterapia, 2013, 87: 93-97. |
| [20] | 木合布力·阿布力孜, 张 兰, 张 敏. 昆仑雪菊中氨基酸的含量分析 [J]. 医药导报, 2011, 30(4): 431-432. |
| [21] | 张彦丽, 韩艳春, 阿依吐伦·斯马义. 分光光度法测定维吾尔药昆仑雪菊中总皂苷的含量 [J]. 西北药学杂志, 2011, 26(2): 87-88. |
| [22] | 张彦丽, 阿布都热合曼·合力力, 阿依吐伦·斯马义. 苯酚-硫酸法测定维吾尔药昆仑雪菊多糖含量的研究 [J]. 药物分析杂志, 2010, 30(11): 2205-2207. |
| [23] | Dias T, Mota-Filipe H, Liu B, et al. Recovery of oral glucose tolerance by wistar rats after treatment with Coreopsis tinctoria infusion [J]. Phytother Res, 2010, 24(5): 699-705. |
| [24] | Dias T, Liu B, Jones P, et al. Cytoprotective effect of Coreopsis tinctoria extracts and flavonoids on tBHP and cytokine-induced cell injury in pancreatic MIN6 cells [J]. J Ethnopharmacol, 2012, 139(2): 485-492. |
| [25] | 张淑鹏, 李琳琳, 木合布力·阿布力孜, 等. 昆仑雪菊提取物对α-葡萄糖苷酶的抑制作用 [J]. 现代生物医学进展, 2011, 11(6): 1055-1058. |
| [26] | 张 燕, 李琳琳, 木合布力·阿布力孜, 等. 新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响 [J]. 中国实验方剂学杂志, 2011, 17(7): 166-169. |
| [27] | Hwang I G, Kim H Y, Shin S L, et al. Biological activities of Coreopsis tinctoria Nutt. flower extracts [J]. Korean J Hortic Sci, 2010, 28(5): 857-863. |
| [28] | Woo J H, Jeong H S, Chang Y D, et al. Antioxidant activities of fractions obtained from flowers of Coreopsis tinctoria Nutt [J]. Korean J Hortic Sci, 2010, 28(1): 115-119. |
| [29] | 曹 燕, 庞市宾, 徐 磊, 等. 金鸡菊提取物体外抗氧化活性 [J]. 中国实验方剂学杂志, 2011, 17(12): 144-147. |
| [30] | 晏小欣, 木尼热·阿不都克里木, 敬思群. 金鸡菊黄色素的提取及抗氧化性的研究 [J]. 中国酿造, 2012, 31(5): 144-148. |
| [31] | 明 婷, 孙玉华, 胡梦颖, 等. 金鸡菊提取物降压及体内抗氧化作用的研究 [J]. 中国实验方剂学杂志, 2012, 18(10): 249-252. |
| [32] | 梁淑红, 哈木拉提, 庞市宾, 等. 金鸡菊提取物降血压化学成分实验研究 [J]. 时珍国医国药, 2010, 21(7): 1619-1621. |
| [33] | 曹 燕, 庞市宾, 徐 磊, 等. 金鸡菊提取物对血管环舒张作用的探讨 [J]. 农垦医学, 2011, 33(2): 148-152. |
| [34] | 凌 冰, 哈木拉提, 刘晓燕, 等. 金鸡菊提取物对肾性高血压大鼠肾素-血管紧张素-醛固酮系统的影响 [J]. 中国药理学通报, 2013, 29(10): 1448-1452. |
| [35] | 凌 冰, 张兰兰, 哈木拉提, 等. 金鸡菊有效部位对高血压小鼠的血压和肾素-血管紧张素系统的影响 [J]. 药物评价研究, 2013, 36(4): 253-256 |
| [36] | 梁淑红, 庞市宾, 刘晓燕, 等. 金鸡菊提取物降血脂作用的动物实验研究 [J]. 农垦医学, 2009, 31(6): 495-498. |
| [37] | 朱 笃, 陈飞彪, 夏剑辉, 等. 金鸡菊总黄酮的提取及含量测定 [J]. 食品科学, 2005, 26(9): 296-298. |
| [38] | Sun Y H, Zhao J, Jin H T, et al. Vasorelaxant effects of the extracts and some flavonoids from the buds of Coreopsis tinctoria [J]. Pharm Biol, 2013, 51(9): 1158-1164. |
 2014, Vol.
2014, Vol. 


