通用名:idelalisib
别名:CAL 101、CAL-101、CAL101、GS 1101、GS-1101、GS1101
化学名:5-氟-3-苯基-2-((1S)-1-(9H-嘌呤-6-基氨基)丙基)-3H-喹唑啉-4-酮
CAS:870281-82-6
分子式:C22H18FN7O
相对分子质量:415.42
结构见图 1
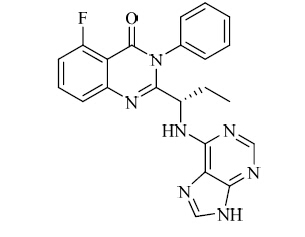 | 图 1 idelalisib的结构Fig. 1 Structure of idelalisib |
原研公司:吉利德科学公司
药理分类:磷脂酰肌醇-3激酶(PI3K)抑制剂
适应症:难治性惰性非霍奇金淋巴瘤(iNHL)、慢性淋巴细胞白血病(CLL)
目前阶段:注册前
给药途径:口服
2 相关背景研究发现,PI3K/Akt信号转导通路是体内重要的细胞生存通路之一,在国外被视为癌细胞存活的首要通路。Akt是一种丝氨酸/苏氨酸蛋白激酶,处于该信号转导的枢纽部位,Akt2是Akt的亚型之一,更多地参与了人类肿瘤的发生和发展。PI3K是一种胞内磷脂酰肌醇激酶,与病毒癌基因表达蛋白v-Src和细胞原癌基因表达蛋白c-Src等癌基因的产物相关,且PI3K本身具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。PI3K可分为3类,其结构与功能各异。其中研究最广泛的为I类PI3K,此类PI3K为异源二聚体,由一个调节亚基和一个催化亚基组成[1]。调节亚基含有SH2和SH3结构域,与含有相应结合位点的靶蛋白相作用,该亚基通常称为p85。催化亚基有4种,即p110 α、β、γ、δ,而δ仅限于白细胞,其余则广泛分布于各种细胞中。PI3K被存在于细胞膜的受体酪氨酸激酶(RTK)激活后,催化磷脂酰肌醇二磷酸PIP2磷酸化为磷脂酰肌醇三磷酸PIP3。与PI3K的功能相反,作为抑癌基因的类脂磷酸酶PTEN催化PIP3去磷酸化为PIP2。PIP3通过激活Akt等促进癌细胞的生长、增殖和血管生成等。流行病学研究发现很多癌症患者中pIK3 CA(表达p110 α的基因)变异或扩增以及PTEN功能丧失,因而PI3K被认为在癌症发生中起重要作用,而以PI3K为靶标的抗癌药物的研发也便成为近年来分子靶向抗癌药物研究领域的热点。
PI3K的激活可以在细胞膜处产生磷脂第二信使,进一步激活多种胞内酶,后者是细胞增殖、存活和细胞活性的调节因素。在B淋巴细胞中,PI3Kδ在正常B细胞发育和功能、B细胞受体以及多种细胞因子、趋化因子、整合素信号转导中起重要的调节作用,活化丝氨酸/苏氨酸激酶Akt及mTOR,并对细胞代谢、迁移、生存、增殖及分化产生调控作用[2]。B细胞癌症细胞中PI3Kδ信号通路经常呈过活化状态,这使得PI3Kδ抑制剂有望成为一种iNHL的有效治疗药物。同时B细胞受体信号通路在CLL的病理学过程中起到重要作用,其最关键的亚型与CLL恶性表型相关[3, 4]。
吉利德正在开发的血癌新药idelalisib是首个选择性口服PI3Kδ抑制剂,与α、β、γ亚基相比,其高度选择性地作用于δ亚基。在淋巴样细胞系和患者原始样本中,idelalisib可阻滞PI3Kδ-Akt信号通路并促进细胞编程性死亡,从而有效治疗iNHL。研究表明idelalisib能够显著增加B细胞急性淋巴细胞白血病(B-ALL)和CLL细胞系的凋亡,同时没有显著增加正常T细胞的凋亡。2013年9月11日,吉利德向FDA提交了idelalisib的新药申请(NDA),寻求批准用于iNHL的治疗,2013年12月6日,吉利德又向FDA提交了idelalisib的新药申请(NDA),寻求批准用于CLL的治疗。治疗CLL,idelalisib近期还获得了FDA突破性疗法认定资格。
3 合成路线[5]向2-氟-6-硝基-N-苯甲酸(1)与DMF的CH2Cl2溶液中逐滴滴加草酰氯的CH2Cl2溶液,室温反应2 h,想上述反应液中加入苯胺和NaHCO3,5~10 ℃下反应10 min得到化合物2。化合物2和DMF在SOCl2中回流搅拌3 h,反应混合物浓缩后得棕色粗品,将其溶解在CH2Cl2溶液中,与N-Boc-L-2-aminobutyric acid室温下反应3 h,得到化合物3。向溶有化合物3的HOAc溶液中分3次加入Zn,室温下反应2 h得到化合物4。化合物4溶于CH2Cl2中,加入TFA搅拌1 h,然后加入K2CO3调pH值大于10,后处理得化合物5,将化合物5、6-bromopur ine和DIEA加入t-BuOH中,80~100 ℃下反应24 h,柱色谱分离得到目标化合物idelalisib。合成路线见图 2。
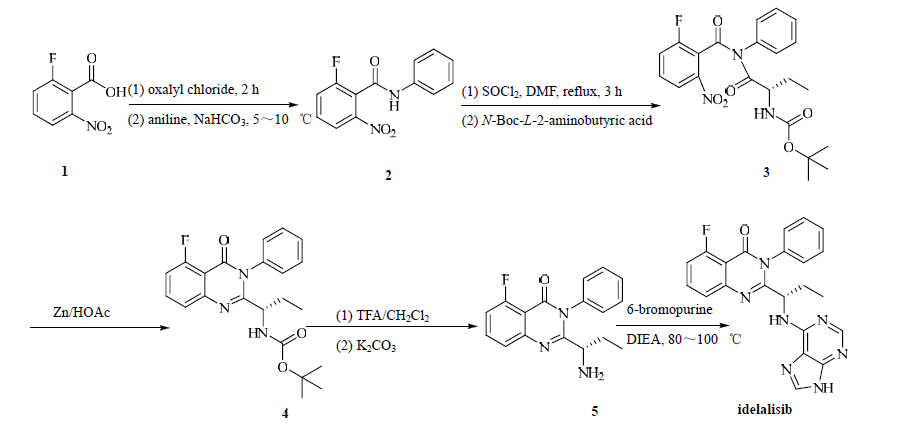 | 图 2 Idelalisib的合成路线Fig. 2 Synthesis route of idelalisib |
idelalisib对p110 α、β、γ作用效果不大,其是一种选择性p110 δ抑制剂,IC50为2.5 nmol/L。其作用于原代嗜碱细胞特定阻断p110 δ调节的CD63表达,EC50为8 nmol/L。与急性髓性白血病(AML)和骨髓增生性肿瘤(MPN)细胞相比,idelalisib作用于B细胞 B-ALL和CLL细胞时显示更强的活性。idelalisib作用于SU-DHL-5、KARPAS-422和CCRF-SB细胞,降低pAktS473、pAktT308和下游靶点S6,EC50为0.1~1.0 μmol/L[6]。idelalisib作用于CLL细胞,诱导选择性细胞毒性,不是通过突变状态或间期细胞遗传学,主要通过caspase依赖机制。与正常B细胞相比,idelalisib作用于CLL细胞优先产生细胞毒性,作用于其他造血细胞不会产生毒性。idelalisib作用于T细胞和天然杀伤细胞缺乏直接的细胞毒性潜能。idelalisib抑制炎症细胞因子的产生,如IL-6、IL-10、TNF-α和IFN-γ,且激活诱导的细胞因子,如CD40L。idelalisib也抗CD40L调节的CLL细胞存活[7, 8]。idelalisib作用于L1236和L591细胞,诱导细胞在G1期积累,在S期下降,说明idelalisib可以作为治疗霍杰金淋巴瘤(HL)的一种新策略[9]。
4.2 药动学研究当剂量在50~200 mg增加时,血浆中idelalisib的量也随着增加,当剂量增加到350 mg时,不再随之增加。在200~350 mg剂量时,一周期内平均药物浓度的波峰和波谷分别为5、1.0 μmol/L[10]。
动物实验中发现犬ig idelalisib后,88%的剂量存在于粪便中,主要代谢产物为idelalisib的氧化产物GS-563117。为进一步测定idelalisib的质量平衡或恢复、代谢物轮廓、药动学,Jin等[11]给予健康受试男性服用单一剂量idelalisib 150 mg,其中idelalisib用14C标记。收集最多21 d的血液、尿液和粪便,或满足下列条件:≥90%的给药剂量在粪便和尿液中排泄,<1%的剂量存在于连续的间隔采样中,以及在连续样品中含量≤2倍背景或尿液/粪便样品中等离子体放射性停止。idelalisib和代谢产物GS-563117的浓度利用LC/MS/MS测定,并且通过LSC测量评估总放射性。在选定的时间点测定尿液、粪便和血浆样品中代谢物谱图。并在整个研究过程进行安全性评估。14C放射率的平均回收率为92%(RSD 1.7%),其中78%(RSD 3.9%)在粪便中,14%(RSD 2.9%)在尿液中。粪便和尿液中GS-563117是主要代谢产物(前者占总放射量的44%,后者占49%)。在服药2 h后观察到血浆放射率峰值,在服药24 h内,体内循环放射率包括idelalisib本身(38%)和其通过醛氧化酶形成的代谢产物GS-563117(62%)。在全血-血浆中14C放射率浓度比值为0.5,这表明相对于其他血细胞组分,idelalisib及其代谢产物主要分布在血浆中,其他低水平代谢产物包括在粪便和尿液中检测到的羟基化和葡萄糖醛酸化产物。
idelalisib主要通过粪便消除,氧化成GS563117是其主要代谢途径。在血浆中仅观察到idelalisib和GS563117,并且可在粪便和尿液中检测到主要代谢产物GS563117。
5 临床研究 5.1 I期临床Ⅰ期数据显示药物idelalisib在以往已接受多次治疗的54例CLL患者(女9例,男45例,年龄37~82岁,80%伴有显著淋巴结腺体肿大,70%为难治性疾病,既往治疗的中位数为5次)中,该药可使半数患者(2例完全应答,28例部分应答)的肿瘤出现快速且持久的缩小,并使疾病进程平均延缓17个月,客观应答率为56%;15例中性粒细胞减少患者中所有患者的血细胞减少复常;25例贫血患者中17例(68%)的血细胞减少复常;20例脾肿大患者中有14例(70%)消退;34例血小板减少患者中27例(79%)的血细胞减少复常。患者口服idelalisib治疗,50~350 mg/次,1~2次/d,平均治疗时间为9个月。常见的不良反应包括疲乏、腹泻、发热、肺炎、天门冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)比值升高,未观察到剂量限制性毒性。
Ⅰ期实验结果表明复发或难治性恶性肿瘤患者在口服idelalisib 50~350 mg,2次/d,28 d后25例患者有应答响应。iNHL、套细胞淋巴瘤、CLL患者的响应率分别为65%(11/17)、75%(6/8)、30%(8/27),弥漫性大B细胞淋巴瘤患者没有响应[12]。
5.2 II期临床Ⅱ期临床中,idelalisib联合利妥昔单抗用药方案对64例老年CLL初治患者平均治疗14个月,完全缓解率和总缓解率分别为19%、97%,93%的患者预估无进展生存期为24个月,无复发报告。3例TP53基因突变与6例17p染色体丢失的患者均得到了缓解,包括3例完全缓解,该特殊情况的患者通常预后较差。上述研究中,三度腹泻和/或结肠炎的发生率为33%,≥3级肺炎的发生率为17%,≥3级转氨酶升高的发生率为23%。
在125名难治性iNHL患者中,服用idelalisib单一制剂得到了53.6%的总有效率,疾病缓解期平均为11.9个月,所有患者的无进展生存期平均值为11.4个月,同时89%患者的淋巴结缩小。并且评价了idelalisib在既往利妥昔单抗和含烷化剂化疗方案治疗的iNHL患者中的疗效和安全性,结果表明,idelalisib单药疗法取得了57%的总体响应率,其中,6%的患者实现了完全响应,50%实现部分响应,1%取得轻微响应。研究中,平均响应持续时间达12.5个月,距离响应的平均时长为1.9个月。平均无进展生存期为11.0个月,平均总生存期为20.3个月,90%的患者经历了淋巴结的缩小[13]。
5.3 III期临床为了考察idelalisib和利妥昔单抗联合应用治疗iNHL的有效性和耐受性,进行了一项Ⅲ期临床试验(NCT01732913),本次试验招募了375名美国、澳大利亚和欧洲的患者。一项随机、双盲的Ⅲ期试验结果显示,在24周内联合idelalisib和利妥昔单抗(93%)治疗无进展生存率比的患者比单一应用利妥昔单抗(46%)更具有显著性,总反应率分别为81%、13%,另外观察由于并发症而不能接受细胞毒治疗的220例CLL患者,试验结果显示在危险因素分层的所有亚组中,idelalisib组均显著延长了预估无进展生存期,idelalisib组患者总生存显著改善,并且具有显著更高的淋巴结反应率(93%、4%)[14]。统计学上证明了idelalisib联合利妥昔单抗能够显著改善无进展生存期、客观缓解期、总生存期的安全性,包括大量预处理的复发白血病患者和具有不利的遗传特征的患者。
2013年10月10日吉利德宣布血癌新药idelalisib在CLL临床试验中显示疗效明显优于利妥昔单抗而提前终止delalisib的一项关键性III期研究,该项研究在既往已接受治疗但不适合化疗的CLL患者中开展[15]。分析结果表明,与利妥昔单抗单药治疗相比,idelalisib+利妥昔单抗联合疗法对研究的主要终点疾病无进展生存期具有显著的积极影响,表现出了高度统计学显著功效。
6 安全性在一单组、公开标签、Ⅱ期研究中,入组了125例对利妥昔单抗和烷化剂药物无缓解的惰性非霍奇金淋巴瘤患者,或接受上述治疗后6个月内出现复发的患者,89%患者疾病阶段为Ⅲ或Ⅳ,30%患者有乳酸脱氢酶升高,26%的患者具有大肿块。受试者均接受idelalisib治疗,剂量为150 mg,2次/d,直到疾病进展或受试者退出试验。患者缓解率为57%,其中6%达到完全缓解的标准。研究者发现,最常见的3级或以上不良事件包括嗜中性粒细胞减少症、氨基转换酶水平上升、腹泻和肺炎。在所有患者中1或2级ALT/AST升高继续治疗后水平恢复到正常范围。结果表明idelalisib治疗经既往治疗的iNHL表现出抗肿瘤活性及可接受的安全性[16]。
一项多中心、随机双盲、安慰剂对照、Ⅲ期研究评估了idelalisib联合利妥昔单抗对比利妥昔单抗加安慰剂治疗CLL的有效性和安全性[17]。到目前为止,腹泻和皮疹似乎是主要的问题。在这项研究中,服用idelalisib的患者中,有40%的人产生一种严重的不良反应,如发热、肺炎。但是对照组中有35%的患者也是如此。这很大程度上归因于利妥昔单抗或癌症本身。
7 结语idelalisib是吉利德研发的PI3Kδ抑制剂,由于临床研究数据非常好,提前中止III期临床研究申请上市。在针对CLL的II期临床研究中,64例CLL患者总应答率为97%,93%的患者无进展生存期在24个月以上。在针对iNHL的II期临床研究中,125例iNHL患者总应答率为53.6%,中位持续应答时间为11.9个月,中位无进展生存期为11.4个月。idelalisib可以延长难以治愈的白血病和淋巴瘤患者的寿命,而无需传统的化疗。这种药物能够靶向白血细胞(被称为B细胞)中的一种特异性酶,对于患有复发性血癌的人来说,它能够显著延长患者的无进展生存期。在一系列临床研究中显示出良好的治疗前景,且安全性及耐受性均较好。
| [1] | Abubaker J, Bavi P, Al-Harbi S, et al. Mutation of the PIK3CA oncogene in human cancers [J]. Oncogene, 2008, 27(25): 3539-3545. |
| [2] | Freeman-Cook K D, Autry C, Borzillo G, et al. Design of selective, ATP-competitive inhibitors of Akt [J]. J Med Chem, 2010, 53(12): 4615-4622. |
| [3] | 徐 卫, 朱华渊, 吴雨洁, 等. 慢性淋巴细胞白血病的诊断、预后与治疗 [J]. 血液病学, 2010, 90-111. |
| [4] | 黄秀兰, 崔国辉, 周克元. PI3K-Akt信号通路与肿瘤细胞凋亡关系的研究进展 [J]. 癌症, 2008, 27(3): 331-336. |
| [5] | Kesicki E A, Zhichkin P. Method of preparing 3-phenyl- 2-[9H-purin-6-ylamino)-methyl]-3H-quinazolin-4-one and substituted and related compounds [P]. US: WO2005113554, 2005-12-01. |
| [6] | Lannutti B J, Meadows S A, Herman S E, et al. CAL-101, a p110 delta selective phosphatidylinositol-3-kinase inhibitor for the treatment of B-cell malignancies, inhibits PI3K signaling and cellular viability [J]. Blood, 2011, 117(2), 591-594. |
| [7] | Herman S E, Gordon A L, Wagner A J, et al. Phosphatidylinositol 3-kinase-δ inhibitor CAL-101 shows promising preclinical activity in chronic lymphocytic leukemia by antagonizing intrinsic and extrinsic cellular survival signals [J]. Blood, 2010, 116(12), 2078-2088. |
| [8] | Kashishian A, Lin T S, Jones J A, et al. CAL-101, a selective inhibitor of the p110-delta isoform of phosphatidylinositol 3-kinase, effectively induces apoptosis in primary chronic lymphocytic leukemia cells providing a novel therapeutic strategy for the treatment of this disease [C]. San Francisco: 50th Annual Meeting and Exposition of the American Society of Hematology, 2008. |
| [9] | Meadows S A, Vega F, Kashishian A, et al. PI3Kδ inhibitor, GS-1101 (CAL-101), attenuates pathway signaling, induces apoptosis, and overcomes signals from the microenvironment in cellular models of Hodgkin lymphoma [J]. Blood, 2012, 119(8): 1897-1900. |
| [10] | Flinn I W, Byrd J C, Furman R R, et al. Evidence of clinical activity in a phase I study of CAL-101, an oral P110 delta isoform-selective inhibitor of phosphatidy- linositol 3-kinase, in patients with relapsed or refractory B-cell malignancies [C]. New York: 51st Annual Meeting and Exposition of the American Society of Hematology, 2009. |
| [11] | Jin F, Robeson M, Zhou H F, et al. Pharmacokinetics, metabolism and excretion of idelalisib [J]. Blood, 2013, 122(21): 5572. |
| [12] | Jennifer B, John B, Richard F, et al. Clinical activity in a phase 1 study of CAL-101, an isoform-selective inhibitor of phosphatidylinositol 3-kinase P110delta, in patients with B-cell malignancies [J]. Hematol J, 2010, 95: 466. |
| [13] | Gilead Announces Interim Phase 2 Data for Idelalisib Showing Response in Refractory Indolent Non-Hodgkin's Lymphoma [OL]. [2014-05-07]. http://www.gilead.com/ news/press-releases/2013/6/gilead-announces-interim-phase- 2-data-for-idelalisib-showing-response-in-refractory-indolent- nonhodgkins-lymphoma#sthash.NWBR658u.dpuf. |
| [14] | Furman R R, Sharman J P, Coutre S E, et al. A phase 3, randomized, double-Blind, placebo-controlled study evaluating the efficacy and safety of idelalisib and rituximab for previously treated patients with chronic lymphocytic leukemia (CLL) [OL]. [2014-05-07]. https:// ash.confex.com/ash/2013/webprogram/Paper66044. html. |
| [15] | Gilead to Stop Phase 3 Study 116 of Idelalisib in Chronic Lymphocytic Leukemia Early Because of Positive Risk-Benefit [OL]. [2014-05-07]. http://www.gilead.com news/press-releases/2013/10/gilead-to-stop-phase-3-study- 116-of-idelalisib-in-chronic-lymphocytic-leukemia-early-because-of-positive-riskbenefit#sthash.PdKnHVBe.dpuf. |
| [16] | Gopal A K, Kahl B S, de Vos S, et al. PI3Kδ inhibition by idelalisib in patients with relapsed indolent lymphoma [J]. N Engl J Med, 2014, 370: 1008-1018. |
| [17] | Furman R R, Sharman J P, Coutre S E, et al. idelalisib and rituximab in relapsed chronic lymphocytic leukemia [J]. N Engl J Med, 2014, 370: 997-1007. |
 2014, Vol.
2014, Vol. 


