2. 天津医科大学 药学院 天津市临床药物关键技术重点实验室, 天津 300070;
3. 天津大学 药物科学与技术学院, 天津 300072
2. Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics (Theranostics), School of Pharmacy, Tianjin Medical University, Tianjin 300070, China;
3. School of Pharmaceutical Science and Technology, Tianjin University, Tianjn 300072, China
海绵为最简单的多细胞动物,是一种原始而奇妙的生物过滤器。大多数海绵来源于海洋,少部分存在于淡水河流或湖泊中。海绵分布广泛,从赤道到两极,从浅海到深海海域都有海绵的存在。自然界中海绵的种类约有15 000种,其颜色、形状千姿百态,大小、质量相差非常大。简单原始的海绵在海底的生存能力非常强,很多海绵对其他海洋生物具有拒食作用,而且也不会被微生物分解。这些现象提示海绵体内应该存在一种化学防御机制,即通过体内代谢出丰富的化学物质来抵御外敌的侵扰。
目前,已经从海绵中发现了大量的具有抗微生物、抗炎、抗肿瘤、抗病毒和免疫调节等活性的化学成分[1]。从海绵中分离得到的化学成分按照化学结构类型可分为脂类、大环内酯类、肽类、生物碱类、甾醇类和萜类等。由于海绵中存在着结构和数量丰富的,且有很大成药性的活性化学成分,使得海绵中天然产物研究一直都是海洋天然产物研究的焦点。本文对近年来海绵中活性化学成分的研究进 展进行了综述。 1 脂类 1.1 多烯炔类成分
Aratake等[2]从印度尼西亚海绵Haliclona sp.中分离得到一种多元不饱和溴代脂肪酸6-bromo- icosa-3Z,5E,8Z,13E,15E-pentaene-11,19-diynoic acid(1),并通过核磁数据确定了其结构。将分离得到的该化合物纯化后进行细胞实验,研究表明其对NBT-T2大鼠膀胱上皮细胞有细胞毒性,半数抑制浓度(IC50)值为36 μg/mL。
Watanabe等[3]从Strongylophora属海绵中分离得到3个多烯炔类成分strongylodiol A、B、C,它们对Molt-4肿瘤细胞有非常显著的细胞毒活性,IC50值分别为0.35、0.85、0.80 μg/mL。 1.2 过氧化物
Plakinidae类过氧化物在海绵中比较常见,该类成分在C-3、6位存在过氧桥,同时在C-3、4、6位有烷基链取代。Ernesto等[4]从中国南海简易扁板海绵Plakortis simplex中分离得到plakortide H(2)、I、J,运用波谱学和化学的方法解析了其平面结构,并利用改良的Mosher法确定C-3、4、6手性位点的绝对构型。plakortide H、I、J对鼠纤维肉瘤细胞WEHI 164显示出较强的活性,其IC50值分别为7.1、9.5、8.2 μg/mL。并阐述了该类化合物的构效关系,认为过氧环是其具有细胞毒活性的活性位点,若过氧环被破坏,其细胞毒活性则会消失。
Dai等[5]通过活性筛选及分离手段从海绵Diacarnus levii中分离得到4种结构新颖的norsesterterpene过氧化物diacarnoxides A~D,其中diacarnoxide B(3)显示出显著的活性,可以抑制低氧状态下肿瘤细胞的生长。
海绵中分离得到的脂类化合物的结构见图 1。
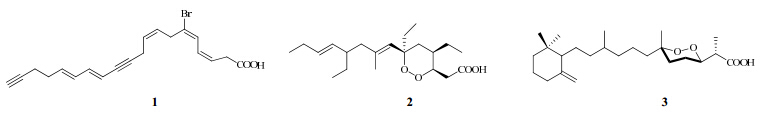 | 图 1 海绵中分离得到的脂类成分的结构Fig. 1 Structures of lipids from marine sponges |
来自海绵的大环内酯类化合物结构新颖、药理活性多样,其已经引起越来越多的海洋药物研究人员的关注。
Johnson等[6]从海绵Cacospongia mycofijiensis中分离得到大环内酯类聚酮化合物fijianolides A(4)、B(5),及6种新型的fijianolides D~I。fijianolides A、B具有类似于紫杉醇的微管稳定作用,其中fijianolides B的作用强于fijianolides A,且在严重联合免疫缺陷(SCID)小鼠肿瘤细胞体内评价中发现:fijianolides B可持续阻断HCT-116肿瘤细胞的生长长达28 d。fijianolides D~I在体外实验中也显示了一定的抗HCT-116和MDA-MB-435细胞系活性,其中fijianolides E、H可以阻断细胞的有丝分裂。
Chevallier等[7]从巴布亚新及利亚海绵Ircinia sp.中分离得到一种有强细胞毒性的大环内脂类化合物tedanolide C及其类似物。体外试验表明该化合物对HCT-116细胞有强的细胞毒性,从细胞周期分析中发现其可使细胞分裂停留在S期。
Singh等[8]从新西兰海绵Mycale hentscheli中分离得到亚微克级的大环内酯类化合物peloruside A、B。其中peloruside B可以促进微管的聚合,同紫杉醇一样可以阻断细胞的有丝分裂在G2期。
海绵中分离得到的大环内酯类化合物的结构见图 2。
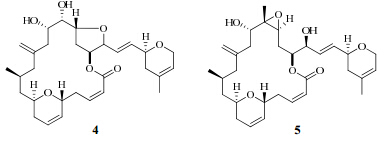 | 图 2 海绵中分离得到的大环内酯类成分的结构Fig. 2 Structures of macrolides from marine sponges |
在近30年中,研究人员从海绵中发现了大量结构新颖且药理活性强的肽类成分,部分化合物结构见图 3。海绵肽类化合物的研究能够取得如此大的进展,主要有以下几个原因:(1)制备型高效液相色谱等分离纯化技术的快速发展与应用;(2)结构 鉴定方面,波谱解析技术的进展,特别是2D-NMR和质谱等技术在海洋肽类结构测定方面的巨大推动作用。很多海绵环肽类成分由于N-端的封闭、β-或γ-氨基酸残基以及D-型氨基酸等新氨基酸存在,已经不能通过Edman降解来获取氨基酸序列的分析结果;(3)手性分离技术的发展,使研究人员能够用极少量的样品就可以确定某一氨基酸的绝对构型。
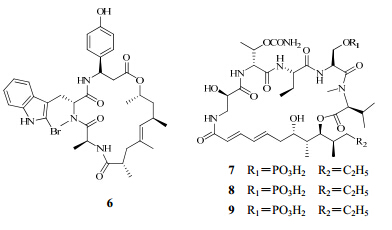 | 图 3 海绵中分离得到的肽类成分的结构Fig. 3 Structures of peptides from marine sponges |
Ebada等[9]从印度尼西亚的加里曼丹岛海绵Jaspis splendens中分离得到化合物jaspamide(6)和其两个衍生物jaspamide Q、R。通过1D和2D NMR核磁数据、质谱分析比较得到了jaspamide的准确结构。jaspamide Q、R可以抑制小鼠淋巴瘤L5178Y细胞的增殖,IC50值<0.1 μg/mL。
Plaza等[10]从帕劳群岛深水水域海绵Theonella swinhoei中分离得到3种新的类似于anabaenopeptin的多肽类化合物paltolides A、B、C。paltolides A、B、C在细胞实验中并没有显示出抗HIV-1活性或细胞毒性,但在亚微摩尔级显示出对羧肽酶的选择性抑制。
Plaza等[11]从海绵Siliquariaspongia mirabilis中分离得到6种新的环肽化合物,它们分属于celebesides A、B、C(7~9)和theopapuamides B、C、D。celebesides A在单轮传染性实验中抗HIV-1活性的IC50值为(1.9±0.4) μg/mL,而在非磷酸化的模拟实验中,celebesides A即使在50 μg/mL这样的高浓度下仍无活性。theopapuamides A、B、C对人体结肠癌细胞HCT-116显示出细胞毒性,IC50值为2.1~4.0 μg/mL,并且有强的 抗真菌活性。
Ratnayake等[12]从巴布亚新几内亚的海绵Theonella swinhoei中分离得到一种结构新颖的环肽theopapuamide,该化合物对CEM-TART和HCT-116细胞系均具有强的细胞毒性,半最大效应浓度(EC50)值分别为0.5、0.9 μmol/L。
Robinson等[13]从两种海绵Auletta sp.和Jaspis splendens中分离得到jasplakinolide和11个jasplakinolide类似物,其中有7个化合物为新化合物。jasplakinolide B显示出非常强的细胞毒性,对人体直肠结肠恶性腺瘤细胞HCT-116的IC50值<1 nmol/L,但是在细胞微丝试验中,即使IC50值为80 nmol/L时也没有显示出微丝破坏活性。 4 生物碱类
生物碱类成分是海绵化学成分研究的一个非常重要的领域。该类成分结构独特,其中许多化合物
具有抗肿瘤、降压、广谱抗菌、抗病毒等生物活性。因此药物开发人员对从中寻找治疗人类重大疾病的特效药物寄予了厚望。 4.1 吲哚类生物碱
Dai等[14]从海绵Smenospongia cerebriformis中分离得到2个新化合物dictazoline A(10)、B(11),以及2个已知化合物tubastrindole A、B,活性筛选结果表明该类化合物既没有显示出明显的细胞毒性,也没有抗菌活性。 4.2 β-咔啉类生物碱
Inman等[15]从巴布亚新几内亚海绵Hyrtios reticulates中分离得到1个β-咔啉生物碱hyrtiocarboline(12),该化合物可选择性抑制H522-T1肺非小细胞、MDA-MB-435黑素瘤细胞、U937淋巴癌细胞系的增殖。同时在该属海绵中还分离得到dragmacidonamine A(13)、B。 4.3 异喹啉类生物碱
异喹啉类生物碱具有很好的抗微生物、抗肿瘤等药理活性。ecteinascidin 743(14)的开发成功使我们认识到了该类化合物具有广阔的新药开发前景[16]。
Pettit等[17]从海绵Cribrochalina sp.中分离得到了3个异喹啉生物碱cribrostatin 3(15)、4、5,并通过X单晶衍射确定了其立体构型。cribrostatin 3、4、5显示出很强的抑制卵巢癌细胞Ovcar-3增殖的活性,其IC50值分别为0.77、2.20、0.18 μmol/L,对鼠白血病细胞P388也有很好的抑制增殖的活性,IC50值为2.49、24.6、0.045 μg/mL。另外,这3个化合物还具有一定的抗微生物活性。 4.4 溴代酪氨酸类生物碱
溴代酪氨酸类生物碱是一类生物活性广泛的成分。Carney等[18]从海绵Pasammaplysilla purpurea中分离得到bastadine(16),其对多种肿瘤细胞均表现出较弱的细胞毒性,在2 μg/mL时,对结肠腺癌、人肺癌细胞A5499、鼠淋巴白血病细胞P388和人体肿瘤细胞HT-2有毒性;当浓度为2.5 μg/mL时,其对无肿瘤CV-1猴肾细胞有一定的毒性。另外,bastadine对拓扑异构酶II(IC50值为2.0 μg/mL)及脱氢叶酸盐还原酶(IC50值为2.5 μg/mL)有抑制作用。
Galeano等[19]从加勒比海绵Verongula rigida分离得到9种bromotyrosine衍生的化合物,其中purealidin B(17)、11-hydroxyaerothionin(18)在10、5 μmol/L时对利什曼原虫和疟原虫显示出选择性抗寄生虫活性。 4.5 吡咯类生物碱
Mao等[20]从海绵Mycale sp.中分离得到18个结构新颖的脂溶性的2,5-二取代吡咯类成分(19)。这些化合物具有一定的阻断缺氧诱导因子-1(HIF-1)活性的作用,IC50值<10 μmol/L。作用机制研究表明,该类化合物在一定浓度下可通过阻断NADH-泛醌氧化还原酶(复合物I)来抑制线粒体的呼吸作用,以此来阻断HIF-1的活性。
Liu等[21]通过活性追踪及色谱方法从海绵Dendrilla nigra中分离得到4个结构新颖的具有分子靶向抗肿瘤活性的片罗素类成分neolamellarin A、neolamellarin B、5-hydroxyneolamellarin B和7- hydroxyneolamellarin A(20)。7-hydroxyneolamellarin A可以阻断低氧诱导下T47D细胞中的HIF-1活性,IC50值为1.9 μmol/L,也可以抑制血管内皮生长因子(VEGF),使其停留在分泌蛋白水平。
季红等[22]从中国南海海绵Iotrochota sp.中分离得到purpurone(21),它是该属海绵中的特征性成分和主要抗氧化活性成分,其清除DPPH自由基的IC50值为19 μg/mL。 4.6 其他
Morgana等[23]从海绵Petrosaspongia mycofijiensis中分离得到mycothiazole及类似物8-O-acetylmycothiazole、4,19-dihydroxy-4,19-dihydromycothiazole;mycothiazole可以抑制低氧诱导下肿瘤细胞中HIF-1的生成,IC50值为1 nmol/L,抑制体外低氧刺激下肿瘤血管的生成,并在体外实验中还表现出一定的神经毒性。
Coello等[24]从肯尼亚的拉姆岛海绵Mycale sp.中分离得到一种环状二胺1,5-diazacyclohenicosane(22),并运用HR-ESI-MS和1D、2D-NMR等波谱学方法确定了其结构。该化合物对A549、HT29和MDA-MB-231肿瘤细胞株显示出中等强度的抑制增殖活性,IC50值分别为5.41、5.07、5.74 μmol/L。
Hermawan等[25]从海绵Leucetta sp.中分离得到一种新型聚炔类生物碱2-(hexadec-13-ene-9,11- diynyl-methyl-amino)-ethanol(23),并通过核磁数据确定其结构。该生物碱对NBT-T2细胞具有较强的细胞毒性,IC50值为2.5 μg/mL。
张浩等[26]从中国南海海绵Axinella sp.中分离得到hymenialdisine(24)和debromohymenialdisine(25)。这两种化合物为吡咯烷生物碱成分,都是MAPK途径抑制剂,其中hymenialdisine可以有效抑制影响丝裂原激活的蛋白激酶1的活性,其IC50值为6 nmol/L,对GSK-3激酶以及CDK家族也显示出很强的抑制活性,其IC50值为10~700 nmol/L。debromohymenialdisine能够具有抑制G2期DNA损伤检查点、检查点激酶1(Chk1)和2(Chk2)的活性,IC50值分别为8、3、315 μmol/L。
海绵中分离得到的生物碱类成分的结构见图 4。
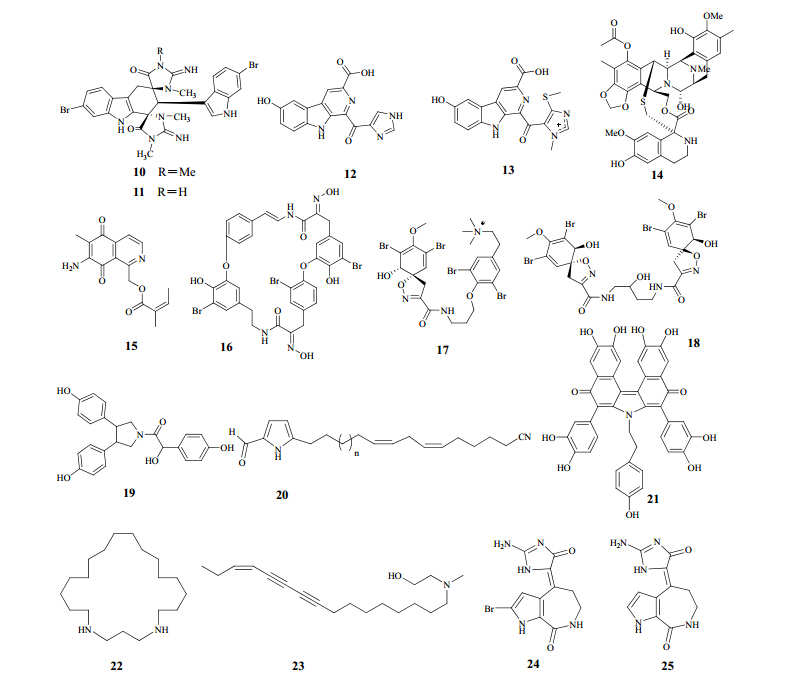 | 图 4 海绵中分离得到的生物碱类成分的结构Fig. 4 Structures of alkaloids from marine sponges |
甾醇是一类分子中环戊烷骈多菲甾核的化学成分,是某些激素的前体,也是生物膜的重要组成部分。甾醇是存在于任何一种生物体内的化学成分。目前在海洋生物中发现了200多种单羟基甾醇,大部分在海绵中都可以找到。另外,从海绵中还分离得到了大量的多羟基甾醇类成分,这些成分大都具有显著的生理活性。
Whitson等[27]从菲律宾海绵Spheciospongia sp.中分离得到3种新的甾醇硫酸盐spheciosterol sulfates A(26)、B、C,通过1D、2D-NMR和HR-ESI-MS等波谱方法确定了它们的结构。这些化合物都可以阻断蛋白激酶Cζ(PKCζ)的活性,IC50值分别为1.59、0.53 、0.11 μmol/L;在细胞实验中显示其也可以阻断NF-κB的活性,EC50值为12~64 μmol/L。
黄孝春等[28]从我国南海的蓖麻海绵Biemna fortis Topsent中分离得到9个甾体。这些化合物均为首次从蓖麻海绵中分离得到,其中化合物cholest-4-ene-3,6-dione(27)在淋巴细胞转移实验中对T和B淋巴细胞的增殖显示出显著的抑制活性。另外,对蛋白质酪氨酸磷酸酯酶PTP1B也有显著的抑制活性,其IC50值为1.6 μmol/L。
Morinaka等[29]从海绵Phorbas amaranthus中分离得到5种新的甾体咪唑类化合物amaranzole B(28)~F和已知结构的amaranzole A(29)。amaranzole B~F属于含有不同羟苯咪唑基侧链的类似物。amaranzole A、C、D中C24位的C-N被C-O键取代分别得到化合物amaranzole B、E和F。这两类咪唑类类似物很可能是因为烯丙基的重排,即C24-N和C24-O交换,同时伴随CO2的脱去而形成的。人结肠癌细胞HTC-116细胞毒活性测试结果表明,amaranzole A无显著毒性(IC50>32 μg/mL)。
Whitson等[30]从菲律宾的科隆岛海绵Lissodendoryx (Acanthodoryx) fibrosa样品中分离得到3个新的硫酸取代的甾醇的二聚体化合物fibrosterol sulfates A、B、C,其中化合物fibrosterol sulfates A(30)、B(31)具有较强的蛋白激酶CPKCζ抑制活性,IC50值分别为16.4、5.6 μmol/L。
Fattorusso等[31]从Cliona nigricans中分离得到两个结构骨架异常奇特的甾体clionastatins A(32)、B(33)。clionastatins A、B为首次发现在自然界中存在的多卤代androstane类甾体,它们对鼠纤维肉瘤细胞WEHI 164、鼠巨噬细胞RAW 264-7和人单核细胞THP-1显示出中等强度的细胞毒活性,其IC50值为0.8~2.0 μg/mL。
Lu等[32]从昆士兰北部海床收集得到的海绵Sollasella moretonensis中分离得到两种A环为芳香环的胆汁酸3-hydroxy-19-nor-1,3,5(10),22-cholatetraen- 24-oic acid和3-hydroxy-19-nor-1,3,5 (10)-cholatrien- 24-oic acid。
从海绵中分离得到的部分甾醇类成分的结构见图 5。
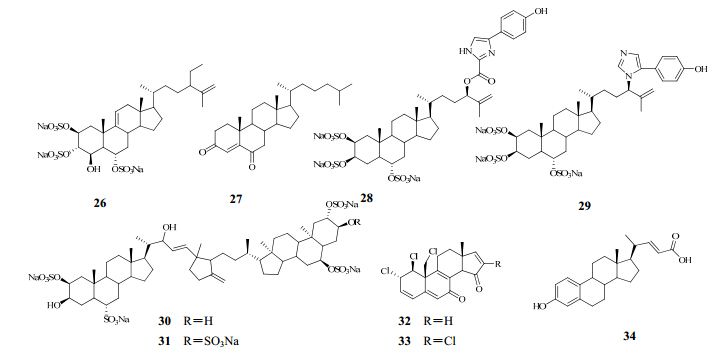 | 图 5 海绵中分离得到的部分甾醇类成分的结构Fig. 5 Structures of steroids from marine sponges |
萜类化合物是一类分子结构中具有(C5H8)n单元的不饱和烷烃及其衍生物。海绵中的萜类化合物结构类型多种多样,并且具有强烈生理活性。 6.1 倍半萜
Xu等[33]从海绵Hyrtios sp.中分离得到一种新的倍半萜-二氢醌puupehanol(35)及已知的化合物puupehenone和chloropuupehenone。puupehenone显示出强的抗新隐球菌和念珠菌活性,最低杀真菌浓度(MFC)值分别为1.25、2.50 μg/mL。 6.2 二倍半萜
黄孝春等[34]从南海倔海绵属海绵Dysidea villosa中分离得到5种scalarane型二倍半萜化合物。抗肿瘤活性筛选结果表明,scalaradial对HL-60、BEL-7402、MDA-MB-435等肿瘤细胞株具有显著的抑制活性,IC50值分别为3.4、5.8、4.8 μmol/L。
邱彦等[35]从中国南海海绵Hyrtios erectus中分离得到8个二倍半萜类化学成分,通过采用多种色谱手段进行分离纯化,应用多种波谱分析技术,并结合文献对照,对所分离到的化合物进行了结构鉴定。其结构分别为furoscalarol、12-O-deacetyl- furoscalarol、16-deacetyl-12-epi-scalarafuran acetate、isoscalarafuran-A、scalarin(37)、12-O-deacetyl-19- deoxyscalarin、12-epi-deoxoscalarin、21-hydroxy- deoxoscalarin。
印度尼西亚海绵Lendenfeldia sp.的脂类提取物可以抑制低氧诱导的T47D胸腺瘤细胞中hypoxiainducible factor-1的活性。Dai等[36]通过色谱分离技术分离得到结构已知的homoscalarane型二倍半萜16β,22-dihydroxy-24-methyl-24-oxoscalaran- 25,12β-olactone(38)、24-methyl-12,24,25-trioxoscalar- 16-en-22-oic acid、12,16-dihydroxy-24-methylscalaran- 25,24-olide、PHC-4 and scalarherbacin A。它们不仅能够抑制低氧诱导的HIF-1的活性(IC50值为0.64~6.9 μmol/L),还有抑制T47D和MDA-MDA-MB-231胸腺肿瘤细胞的增殖活性。 6.3 三萜
海绵中三萜的种类和数量都相对较少,主要可以分为异臭椿型、siphonella型和羊毛甾烷型3大类。
Dai等[37]通过活性筛选及多种分离手段从南非海绵Axinella sp.中分离得到7个结构新颖的sodwanone三萜类化合物3-epi-sodwanone K(39)、3-epi-sodwanone K-3-acetate、10,11-dihydrosodwanone B、sodwanones T~W和结构新颖的yardenone三萜类化合物12R-hydroxyyardenone,以及结构已知的化合物sodwanone A、sodwanone B、yardenone。sodwanone V可同时阻断低氧诱导和铁离子螯合剂(1,10-邻二氮杂菲)诱导下T47D胸腺肿瘤细胞中HIF-1的活性(IC50值为15 μmol/L)。化合物3-epi-sodwanone K、sodwanones T、10, 11-dihydro- sodwanone B和sodwanone A可以抑制T47D细胞中HIF-1的活性。化合物3-epi-sodwanone K-3-acetate对T47D细胞有一定的细胞毒性(IC50值为22 μmol/L),化合物sodwanones V对MDA-MB-231胸腺肿瘤细胞有一定的细胞毒性(IC50值为23 μmol/L)。
唐生安等[38]采用多种色谱手段对中国南海海绵Jaspis sp.的化学成分进行了分离纯化,应用波谱分析技术(包括IR、MS、2D-NMR等),并结合文献对照,对所分离到的化合物进行了结构鉴定,分别为异臭椿类三萜化合物stellettin A(40)~D、H、I、rhabdastrellic acid A和geoditin B。该类化合物具有很强的抗肿瘤、抗病毒等生理活性,所以极具研究开发和应用价值。
海绵中分离得到的萜类化合物的结构见图 6。
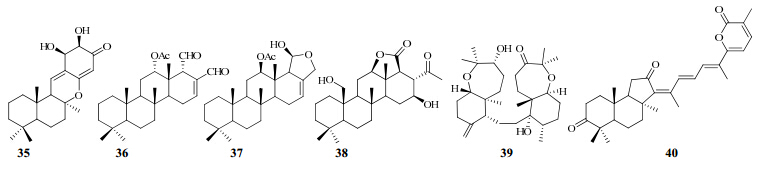 | 图 6 海绵中分离得到的部分萜类成分的结构Fig. 6 Structures of terpenoids from marine sponges |
海洋是生命来源的摇篮,是全球生态环境的重要组成部分。和陆地环境相比,海洋中生物的生长环境具有一定的特殊性,如高盐、高压、缺氧、缺少光照等。在这种特殊的环境下,海洋生物在生长和代谢过程肯定会与陆地生物存在很大的差异,它们的次生代谢产物化学结构特殊,生物活性新颖,是开发海洋药物的重要资源[39]。近年来,海洋生物尤其是海绵在药物研究领域显现出中的重要性促使各国政府竞相投入巨资进行海洋天然产物和海洋药物的研究。我国海绵资源极为丰富,据估计约有5 000种,但报道过化学成分的海绵却很少,这与我国丰富的海绵生物资源很不相称。为了更好的利用这些海绵资源,寻找更多具有生理活性的先导化合物,开发有药用前景的海洋天然产物,寻求更理想的治疗药物,这需要广大研究者潜心研究,还需投入更多的人力、物力!
| [1] | 王旭东, 范 伟, 于豪冰, 等. 扁板海绵属化学成分及生物活性研究进展 [J]. 中草药, 2011, 42(8): 1633-1645. |
| [2] | Aratake S, Trianto A, Hanif N, et al. A new polyunsaturated brominated fatty acid from a Haliclona sponge [J]. Mar Drugs, 2009, 7(4): 523-527. |
| [3] | Watanabe K, Tsuda Y, Yamane Y, et al. Strongylodiols A, B and C, new cytotoxic cetylenic alcohols isolated from the Okinawan marine sponge of the genus Strongylophora as each enantiomeric mixture with adifferent ratio [J]. Tetrahedron Lett, 2000, 41(48): 9271-9276. |
| [4] | Ernesto F, Taglialatela-Scafati O, Di Rosa M, et al. Metabolites from the sponge Plakortis simplex. Part 3: Isolation and stereostructure of novel bioactive cycloperoxides and diol analogues [J]. Tetrahedron, 2000, 56(40): 7959-7967. |
| [5] | Dai J, Liu Y, Zhou Y D, et al. Hypoxia-selective antitumor agents: norsesterterpene peroxides from the marine sponge Diacarnus levii preferentially suppress the growth of tumor cells under hypoxic conditions [J]. J Nat Prod, 2007, 70(1):130-133. |
| [6] | Johnson T A, Tenney K, Cichewicz R H, et al. Sponge-derived fijianolide polyketide class: further evaluation of their structural and cytotoxicity properties [J]. J Med Chem, 2007, 50(16): 3795-3803. |
| [7] | Chevallier C, Bugni T S, Feng X, et al. Tedanolide C: a potent new 18-membered ring cytotoxic macrolide isolated from the Papua New Guinea marine sponge Ircinia sp. [J]. J Org Chem, 2006, 71(6): 2510-2513. |
| [8] | Singh A J, Xu C X, Xu X, et al. Peloruside B, a potent antitumor macrolide from the New Zealand marine sponge Mycale hentscheli: isolation, structure, total synthesis, and bioactivity [J]. J Org Chem, 2010, 75(1): 2-10. |
| [9] | Ebada S S, Wray V, de Voogd N J, et al. Two new jaspamide derivatives from the marine sponge Jaspis splendens [J]. Mar Drugs, 2009, 7(3): 435-444. |
| [10] | Plaza A, Keffer J L, Lloyd J R, et al. Paltolides A-C, anabaenopeptin-type peptides from the palausponge Theonella swinhoei [J]. J Nat Prod, 2010, 73(3): 485-488. |
| [11] | Plaza A, Bifulco G, Keffer J L, et al. Celebesides A-C and theopapuamides B-D, depsipeptides from an Indonesian sponge that inhibit HIV-1 entry [J]. J Org Chem, 2009, 74(2): 504-512. |
| [12] | Ratnayake A S, Bugni T S, Feng X, et al. Theopapuamide, a cyclic depsipeptide from a Papua New Guinealithistid sponge Theonella swinhoei [J]. J Nat Prod, 2006, 69(11): 1582-1586. |
| [13] | Robinson S J, Morinaka B I, Amagata T, et al. New structures and bioactivity properties of jasplakinolide (jaspamide) analogues from marine sponges [J]. J Med Chem, 2010, 53(4): 1651-1661. |
| [14] | Dai J, Jiménez J I, Kelly M, et al. Dictazoline A and B, bisspiroimidazolidinones from the marine sponge Smenospongia cerebriformis [J]. J Nat Prod, 2008, 71(7): 1287-1290. |
| [15] | Inman W D, Bray W M, Gassner N C, et al. A β-carboline alkaloid from the Papua New Guineamarine sponge Hyrtios reticulates [J]. J Nat Prod, 2010, 73(2): 255-257. |
| [16] | Aune G J, Furuta T, Pommier Y. Ecteinascidin 743: a novel anticancer drug with a unique mechanism of action [J]. Anticancer Drugs, 2002, 13(6): 545-555. |
| [17] | Pettit G R, Knight J C, Collins J C, et al. Antineoplastic agents 430. Isolation and structure of cribrostatins 3, 4, and 5 from the republic of maldivescribrochalina species [J]. J Nat Prod, 2000, 63(6): 793-798. |
| [18] | Carney J R, Scheuer P J, Kelly-Borges M. A new bastadin from the sponge Psammaplysilla purpurea [J]. J Nat Prod, 1993, 56(1): 153-157. |
| [19] | Galeano E, Thomas O P, Robledo S, et al. Antiparasitic bromotyrosine derivatives from the marine sponge Verongula rigida [J]. Mar Drugs, 2011, 9(10): 1902-1913. |
| [20] | Mao S C, Liu Y, Morgan J B, et al. Lipophilic 2,5- disubstituted pyrroles from the marine sponge Mycale sp. inhibit mitochondrial respiration and HIF-1 activation [J]. J Nat Prod, 2009, 72(11): 1927-1936. |
| [21] | Liu R, Liu Y, Zhou Y D, et al. Molecular-targeted antitumor agents. 15. Neolamellarins from the marine sponge Dendrilla nigra inhibit hypoxia-inducible factor-1 activation and secreted vascular endothelial growth factor production in breast tumor cells [J]. J Nat Prod, 2007, 70(11): 1741-1745. |
| [22] | 季 红, 刘永宏, 袁 枚, 等. 南海海绵Iotrochota sp.中抗氧化活性成分的研究 [J]. 华西药学杂志, 2009, 24(2): 118-119. |
| [23] | Morgana J B, Mahdi F, Liu Y, et al. The marine sponge metabolite mycothiazole: a novel prototype mitochondrial complex I inhibitor [J]. Bioorg Med Chem, 2010, 18(16): 5988-5994. |
| [24] | Coello L, Martín M J, Reyes F. 1,5-diazacyclohenicosane, a new cytotoxic metabolite from the marine sponge Mycale sp. [J]. Mar Drugs, 2009, 7(3): 445-450. |
| [25] | Hermawan I, de Voogd N J, Tanaka J. An acetylenic alkaloid from the calcareous sponge Leucetta sp. [J]. Mar Drugs, 2011, 9(3): 382-386. |
| [26] | 张 浩, 靳 艳, 张 卫. 南海海绵Axinella sp.中两个含吡咯七元环内酰胺生物碱的分离鉴定 [J]. 中药材, 2006, 29(12): 1299-1301. |
| [27] | Whitson E L, Bugni T S, Chockalingam P S, et al. Spheciosterol sulfates, PKCζ inhibitors from a philippine sponge Spheciospongia sp. [J]. J Nat Prod, 2008, 71(7): 1213-1217. |
| [28] | 黄孝春, 刘海利, 郭跃伟. 南海蓖麻海绵Biemna fortis Topsent化学成分及其生物活性 [J]. 中国天然药物, 2008, 6(5): 348-353. |
| [29] | Morinaka B I, Pawlik J R, Molinski T F. Amaranzoles B-F, imidazole-2-carboxy steroids from the marine sponge Phorbas amaranthus. C24-N- and C24-O-analogues from a divergent oxidative biosynthesis [J]. J Org Chem, 2010, 75(8): 2453-2460. |
| [30] | Whitson E L, Bugni T S, Chockalingam P S, et al. Fibrosterol sulfates from the Philippine sponge Lissodendoryx (Acanthodoryx) fibrosa: sterol dimers that inhibit PKCζ [J]. J Org Chem, 2009, 74(16): 5902-5908. |
| [31] | Fattorusso E, Taglialatela-Scafati O, Petrucci F, et al. Polychlorinated androstanes from the burrowing sponge Cliona nigricans [J]. Org Lett, 2004, 6(10): 1633-1635. |
| [32] | Lu Z, Van Wagoner R M, Harper M K, et al. Two ring-a-aromatized bile acids from the marine sponge Sollasella moretonensis [J]. Nat Prod Commun, 2010, 5(10): 1571-1574. |
| [33] | Xu W H, Ding Y, Jacob M R, et al. Puupehanol, a sesquiterpene-dihydroquinone derivative from the marine sponge Hyrtios sp. [J]. Bioorg Med Chem Lett, 2009, 19(21): 6140-6143. |
| [34] | 黄孝春, 刘海利, 郭跃伟, 等. 两种南海倔海绵Dysidea villosa和Dysidea marshalla的化学成分 [J]. 中国天然药物, 2008, 6(6): 425-429. |
| [35] | 邱 彦, 邓志威, 裴月湖, 等. 中国南海海绵Hyrtios erectus中二倍半萜类化学成分 [J]. 中国天然药物, 2003, 1(3): 137-141. |
| [36] | Dai J Q, Liu Y, Zhou Y D, et al. Cytotoxic metabolites from an Indonesian sponge Lendenfeldia sp. [J]. J Nat Prod, 2007, 70(11): 1824-1826. |
| [37] | Dai J Q, James A F, Zhou Y D, et al. Sodwanone and yardenone triterpenes from a South African species of the marine sponge Axinella inhibit hypoxia-inducible factor-1 (HIF-1) activation in both breast and prostate tumor cells [J]. J Nat Prod, 2006, 69(12): 1715-1720. |
| [38] | 唐生安, 邓志威, 李 军, 等. 南海海绵Jaspis sp.中的异臭椿类三萜成分 [J]. 中国天然药物, 2005, 3(4): 213-218. |
| [39] | 曹桂东, 张红军, 骆 昉, 等. Phakellia属海绵次生代谢产物研究进展 [J]. 药物评价研究, 2012, 35(2): 130-135. |
 2014, Vol. 29
2014, Vol. 29


