2. 哈尔滨商业大学 抗肿瘤天然药物教育部工程研究中心, 黑龙江 哈尔滨 150076;
3. 齐齐哈尔富拉尔基区中医医院, 黑龙江 齐齐哈尔 161041;
4. 哈尔滨商业大学 药学院, 黑龙江 哈尔滨 150076
2. Engineering Research Center of Natural Antineoplastic Drugs, Ministry of Education, Harbin University of Commarce, Harbin 150076, China;
3. Qiqihar Fulaerji District Hospital of Traditional Chinese Medicine, Qiqihar 161041, China;
4. College of Pharmacy, Harbin University of Commerce, Harbin 150076, China
白屈菜为罂粟科植物白屈菜Chelidonium majus L.的带花干燥全草,始载于《救荒本草》[1]。白屈菜性凉,味苦,有毒,归肺、胃经,具有解痉止痛、止咳平喘等功效,主治胃痛、腹痛、肠炎、痢疾、慢性支气管炎、百日咳、咳嗽、黄疸等。对白屈菜的化学成分研究发现,白屈菜的有效成分为生物碱类物质[2],其中白屈菜碱为主要有效成分之一[3, 4],属于苯并菲啶类生物碱,其分子式为C20H19O5N,相对分子质量为353.37,比旋度为+115°,熔点为136 ℃。白屈菜碱为单斜棱柱结晶,不溶于水,溶于乙醇、氯仿,其结构见图 1。近年来药理学研究表明,白屈菜碱具有抗肿瘤、镇痛、解痉等多方面的药理作用,越来越受到国内外科研工作者的关注。本文对白屈菜碱药理作用的研究进展进行总结。
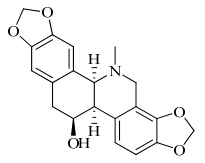 | 图 1 白屈菜碱的结构Fig. 1 Structure of chelidonine |
关于白屈菜碱抗肿瘤作用的研究在国内外已有不少报道。体外研究表明其对胃癌、白血病、鼻咽癌、肝癌细胞都有显著的抑制作用[5, 6]。白屈菜碱可通过不同的机制发挥抗肿瘤作用,是一种有前途的抗肿瘤化疗药物。
恶性黑色素瘤对常规化疗具有很强的抵抗力。如果一个新的天然产物对黑色素细胞具有抗增殖活性,会被认为是用于治疗癌症有前途的药物。研究显示白屈菜碱对两个p53野生型和两个p53突变型黑色素瘤细胞系均具有强的抗增殖活性[7]。采用流式细胞仪,Annexin V/PI双染,发现白屈菜碱可以诱导原代人葡萄膜黑色素瘤细胞系(OCM-1)凋亡[8]。Kaminskyy等[9]研究表明白屈菜碱主要诱导DNA损伤,在给药浓度为4 μg/mL时,24 h内造成15%~20%的细胞发生DNA损伤,从而诱导肿瘤细胞发生凋亡。端粒酶在正常体细胞中处于失活状态,其活化是细胞永生化或恶化的重要标志,通过降低端粒酶活性可以诱导肿瘤细胞凋亡[10]。白屈菜碱在给药浓度为12 μmol/L时,可以通过下调肿瘤细胞端粒酶活性,从而诱导细胞凋亡。白屈菜碱还可下调人肝癌HepG2细胞端粒酶逆转录酶(hTERT)的表达,降低端粒酶-1抑制剂AC活性,从而诱导HepG2细胞凋亡[11, 12]。此外,白屈菜碱可通过激活p38-p53通路和PI3K/AKT信号传导通路诱导人宫颈癌HeLa细胞凋亡[13]。但是在恶性黑色素瘤中,白屈菜碱可以不受p53基因的影响,而通过线粒体途径诱导细胞凋亡[7]。白屈菜碱对多种肿瘤细胞以及多药耐药性细胞都显示出抗癌潜力,但由于其口服生物利用度差,使得它的应用相当有限。有学者采用纳米技术制成了白屈菜碱聚乳酸-羟基乙酸共聚物(PLGA)纳米粒,并与白屈菜碱的抗肿瘤作用及机制进行了比较。体外实验中纳米白屈菜碱显示出快速的细胞摄取和更强的凋亡作用(IC50值降低46.6%),将HepG2细胞阻断在G2/M期。p53、 cyclinD1、Bax、Bcl-2蛋白、细胞色素C、Apaf-1、caspase-9和caspase-3的蛋白表达也证明了纳米白屈菜碱优于白屈菜碱。体内研究证实100 mg/kg纳米白屈菜碱表现出较好的组织分布曲线而不引起任何的小鼠毒性。纳米白屈菜碱可渗入脑组织,从而说明在肿瘤治疗中具有更大的潜力[14]。
白屈菜碱作用于细胞周期,能够抑制维管蛋白聚合[15]。对白屈菜在两个正常细胞(猴肾细胞和皮肤成纤维Hs27细胞)、两个转染细胞(非洲绿猴肾Vero细胞和Graham 293)和两个恶性细胞(鳞状食管癌WHCO5细胞和人宫颈癌HeLa细胞)中的作用进行了研究。研究发现白屈菜碱是细胞生长的弱抑制剂,但没有证据表明其有选择性的细胞毒性。白屈菜碱抑制微管蛋白聚合,IC50值为24 μmol/L,说明其具有破坏细胞微管结构的能力。白屈菜碱诱导G2/M期阻滞,细胞呈现不正常的中期形态,CyclinB1表达增强,Cdc2激酶活性增强。所有研究细胞的SAPK/JNK激酶途径均被激活[16]。白屈菜碱能有效抑制人胃癌SGC-7901细胞的增殖,当给药剂量在6.25~25 μmol/L时,随着给药剂量增加,细胞出现多核大核[17]。白屈菜碱也可以显著下调人胃癌SGC-7901细胞Cdk1和CyclinB1的蛋白表达水平,上调p-Cdk1蛋白表达水平,从而降低细胞周期检查点关键蛋白Cdk1-cyclinB复合物的形成,进而导致SGC-7901细胞发生G2/M期阻滞,从而导致有丝分类灾难发生[18]。
2 镇痛、镇静作用白屈菜碱有类似吗啡的镇痛作用,作用时间可达4~48 h。何志敏等[19]采用小鼠扭体法、热板法和福尔马林实验对白屈菜碱的镇痛作用进行研究。实验采用灌胃给药,白屈菜碱给药浓度分别为5、10、20 mg/kg。结果表明白屈菜碱可剂量相关性地减少小鼠扭体法中小鼠扭体次数,明显提高热板法中小鼠的痛阈值。福尔马林实验中小鼠高剂量给药组可对福尔马林引起的早期和晚期疼痛反应有抑制作用,而较低剂量组对晚期疼痛抑制作用显著。表明其镇痛作用主要是外周性的,不能被吗啡受体拮抗剂纳络酮拮抗。白屈菜碱的6位烷氧基取代和6位酰氧基取代衍生物还可以抑制中枢神经系统,特别对神经末梢作用较强,并且具有镇静催眠的作用[20]。以白屈菜碱为主要成分的镇痛药物已经应用于临床。胃痛舒胶囊可治疗胃肠痉挛、慢性胃炎、胃溃疡、十二指肠溃疡等胃病的引起的疼痛,其主要成分为白屈菜碱和原阿片碱。白屈菜碱和青藤碱为主要成分的复方中药痛安注射液,具有通络止痛的作用,可用来治疗放化疗或非放化疗的胃癌、肺癌、肝癌等由血瘀引发的癌症中度疼痛等。
3 解痉作用白屈菜碱具有解痉和舒张作用,可抑制各种平滑肌痉挛,特别对胃肠道、支气管和泌尿系统的平滑肌痉挛有明显的解痉作用[21, 22]。在豚鼠离体回肠的解痉测试模型中显示,白屈菜碱对卡巴可(拟胆碱药,也用作副交感神经兴奋药)和电场诱导豚鼠痉挛有抑制作用。Hiller等[23]采用白屈菜碱、原阿片碱、黄连碱作为解痉药物,运用豚鼠离体回肠实验进行研究。结果表明,白屈菜碱对卡巴可和电场诱导的痉挛有非竞争性拮抗作用,且作用效果最强。白屈菜碱在0.25~0.5 mg/mL时抑制卡巴可和电场诱导的痉挛作用率达到50%。
4 对肝脏的保护作用Paul等[24]通过实验证实白屈菜碱PLGA纳米胶囊可以降低由氯化镉(CdCl2)诱导产生的小鼠肝毒性。小鼠ip CdCl2 1 mg/kg,镉染毒30 d后,体内活性氧积累量增加,脂质过氧化作用增强,肝脏上标记酶(ALT、ASY、ALP)、谷胱甘肽(GSH)和其他抗氧化酶(SOD、CAT、GR)的水平降低。白白屈菜碱PLGA纳米胶囊给药治疗30 d后,氧化应激反应和脂质过氧化反应明显减少,谷胱甘肽、胆固醇、三酰甘油和抗氧化酶水平得以修复,表明白屈菜碱PLGA纳米胶囊对镉中毒小鼠的肝脏具有很好的保护作用。通过炎症反应和凋亡信号蛋白的表达也表明白屈菜碱PLGA纳米胶囊有肝脏保护能力,可以作为保护小鼠镉中毒的合理药物。
血清单胺氧化酶的活性高低能反映肝纤维化的程度,是诊断肝硬化的重要指标。Iagodina等[25]通过研究发现,白屈菜碱、白屈菜红碱、血根碱可以降低肝脏线粒体单胺氧化酶(MAO)活性,具有很好的肝脏保护作用,其中白屈菜碱作用较强,有临床研究价值。Iagodina[26]等和Basova等[27]用北美水貂与欧洲水貂进行对比研究,研究发现白屈菜碱等生物碱对MAO-A有明显的抑制作用,当浓度≤10 mol/L时,对5-羟色胺、酪胺、色胺有脱氨基作用,但对苄胺和苯乙胺则无此作用。
5 对心血管的影响白屈菜碱有兴奋心脏、扩张冠脉血管、升高血压的作用。研究表明,白屈菜碱给药0.01~0.02 mg时,可兴奋离体蛙心,同时减慢心搏。当剂量达到0.05 mg以上,会引起心律不齐、舒张期心停等症状。另有研究表明,白屈菜碱能轻微而持久地降低猫动脉压,而不影响呼吸。用肾上腺素预处理再以白屈菜碱灌注血管,比单纯使用复方氯化钠灌注更大程度的扩张血管。若血管不经预先处理,则白屈菜碱对血管无作用[28]。
6 对肾脏的保护作用镉是一种累积性的肾毒物,优先积累于肾脏。Koriem等[29]采用镉中毒大鼠建立肾毒性模型,观察白屈菜碱对镉中毒大鼠肾脏的影响。大鼠氯化镉染毒9周后用白屈菜碱进行治疗。结果表明,白屈菜碱可以通过增加尿排泄而潴留钠离子的作用降低模型大鼠的肾毒性,从而保护镉中毒大鼠肾脏。
7 抗菌作用白屈菜碱具有抑菌作用[30]。在体内可抑制结核杆菌,在体外可抑制甲型链球菌、肺炎双球菌和其他革兰阳性菌[31]。采用二倍稀释法将白屈菜碱乙醇溶液按照0.1 g/mL原液等比稀释成9个不同浓度,白屈菜碱乙醇溶液对变形链球菌均无抑制作用[32]。此外,白屈菜碱对考夫曼-沃尔夫毛癣菌和絮状皮癣菌Epidermophyton flccosum (Harz) Langer均有抑制作用[33]。
8 其他作用Vavrecková等[34]实验证明,白屈菜碱能够抑制人类角质细胞的增长。另外有研究证实,4~10 mg/kg白屈菜碱能阻止或延缓豚鼠过敏性休克的出现。
指环虫是一种最常见的寄生虫病,严重可导致淡水鱼的高发病率和死亡率。有研究报道,白屈菜碱可作为一种抗寄生虫新药,并且药效好于传统防治寄生虫药甲苯咪唑[35]。曾建德[36]研究了白屈菜碱对敌百虫、氧化乐果防治棉铃虫的增效作用,研究发现白屈菜碱单剂用药对敌百虫、氧化乐果防治棉铃虫致死率为20.83%,杀虫效果不明显。单剂敌百虫、氧化乐果对棉铃虫的半数致死量(LD50)分别为0.0218、0.0823 mg/头。白屈菜碱与敌百虫、氧化乐果按比例混合后,毒力最大可分别增加2.142、2.888倍,表明白屈菜碱对敌百虫、氧化乐果防治棉铃虫均具有较好的增效作用。
9 结语白屈菜碱具有抗肿瘤、镇痛、解痉等多方面的药理作用,并且越来越受到国内外科研工作者的关注,特别是其在抗肿瘤方面体现出较好的应用价值。目前,白屈菜碱的硫代磷酸衍生物Ukrain(NSC-631570)已经作为一种抗肿瘤药物应用于临床,对肺癌、乳腺癌、前列腺癌、胰腺癌的治疗均有良好疗效[37, 38, 39, 40]。Ukrain经证实可以使细胞周期调节蛋白Cyclin B1水平升高,细胞周期依赖性蛋白激酶Cdc2活性增强,诱导肿瘤细胞发生G2/M期阻滞[39],形态学表现为抑制微管蛋白聚合,破坏微管结构,从而导致有丝分裂灾难[42, 43]。可以通过诱导细胞色素C释放,从而导致人胶质母细胞瘤细胞凋亡[44, 45]。Ukrain还可以通过下调胶质母细胞瘤基质金属蛋白酶(MMP-2、MMP-9)和SPARC的表达,有效抑制胶质母细胞瘤的增殖[46]。从目前的研究现状表明,白屈菜碱是一种潜在的抗肿瘤药物,其抗肿瘤作用机制的阐明将为白屈菜碱相关药物的研发及应用提供科学依据。
| [1] | 南京中医药大学. 中药大辞典 [M]. 第2版. 上海: 上海科学技术出版社, 2006: 1000. |
| [2] | 韦祖巧, 邹 翔, 曲中原, 等. 白屈菜化学成分和药理作用的研究进展 [J]. 中草药, 2009, 40(增刊): 38-40. |
| [3] | 黄 松, 杜方麓. 罂粟科白屈菜族的化学成分及植物化学分类依据的研究进展 [J]. 湖南中医药导报, 2002, 8(10): 582-584. |
| [4] | Lei Q F, Zhao X L, Xu L J, et al. Chemical constituents of plants from tribe chelidonieae and their bioactivities [J]. Chin Herb Med, 2014, 6(1): 1-21. |
| [5] | 杨秀伟, 冉福香, 王瑞卿, 等. 44种生物碱类化合物对人鼻咽癌细胞株KB和人白血病细胞株HL-60细胞增殖抑制活性的筛选 [J]. 中国现代中药, 2007, 9(1): 8-13. |
| [6] | Kaminskyy V, Lin K W, Filyak Y, et al. Differential effect of sanguinarine, chelerythrine and chelidonine on DNA damage and cell viability in primary mouse spleen cells and mouse leukemic cells [J]. Cell Biol Int, 2008, 32(2): 271-277. |
| [7] | Hammerová J, Uldrijan S, Táborská E, et al. Benzo[c] phenanthridine alkaloids exhibit strong anti-proliferative activity in malignant melanoma cells regardless of their p53 status [J]. J Dermatol Sci, 2011, 62(1): 22-35. |
| [8] | Kemény-Beke A, Aradi J, Damjanovich J, et al. Apoptotic response of uveal melanoma cells upon treatment with chelidonine, sanguinarine and chelerythrine [J]. Cancer Lett, 2006, 237(1): 67-75. |
| [9] | Kaminskyy V, Kulachkovskyy O, Stoika R. A decisive role of mitochondria in defining rate and intensity of apoptosis induction by different alkaloids [J]. Toxicol Lett, 2008, 177(3): 168-181. |
| [10] | 梁寒晖. 端粒酶在胃癌中的作用研究进展 [J]. 右江医学, 2008, 36(2): 214-216. |
| [11] | Noureini S K, Wink M. Transcriptional down regulation of hTERT and senescence induction in HepG2 cells by chelidonine [J]. World J Gastroenterol, 2009, 15(29): 3603-3610. |
| [12] | Paul A, Das S, Das J, et al. Cytotoxicity and apoptotic signalling cascade induced by chelidonine-loaded PLGA nanoparticles in HepG2 cells in vitro and bioavailability of nano-chelidonine in mice in vivo [J]. Toxicol Lett, 2013, 222(1): 10-22. |
| [13] | Paul A, Bishayee K, Ghosh S, et al. Chelidonine isolated from ethanolic extract of Chelidonium majus promotes apoptosis in HeLa cells through p38-p53 and PI3K/AKT signalling pathways [J]. Zhong Xi Yi Jie He Xue Bao, 2012, 10(9): 1025-1038. |
| [14] | Paul A, Das S, Das J, et al. Cytotoxicity and apoptotic signalling cascade induced by chelidonine-loaded PLGA nanoparticles in HepG2 cells in vitro and bioavailability of nano-chelidonine in mice in vivo [J]. Toxicol Lett, 2013, 222(1): 10-22. |
| [15] | Isolani M E, Pietra D, Balestrini L, et al. The in vivo effect of chelidonine on the stem cell system of planarians [J]. Eur J Pharmacol, 2012, 686(1/3): 1-7. |
| [16] | Panzer A, Joubert A M, Bianchi P C, et al. The effects of chelidonine on tubulin polymerisation cell cycle progression and selected signal transmission pathways [J]. Eur J Cell Biol, 2001, 80(1): 111-118. |
| [17] | Qu Z Y, Zou X, Zhao J W, et al. Effect of chelidonine on the expressions of CDK1 and cyclinB1 proteins in SGC-7901 cells [J]. Adv Mater Res, 2013, 790: 594-597. |
| [18] | QU Z Y, Zou X, Zhao J W, et al. Mitotic catastrophe induced by chelidonine on human gastric carcinoma SGC-7901 cells [J]. Adv Mater Res, 2013, 790: 562-565. |
| [19] | 何志敏, 佟继铭, 宫凤春. 白屈菜碱镇痛作用研究 [J]. 中草药, 2003, 34(9): 837-838. |
| [20] | Jagiełło-Wójtowicz E, Chodkowska A, Gadzikowska M, et al. Preliminary evaluation of CNS effects of 6-O-substituted chelidonine derivatives [J]. Acta Pol Pharm, 2003, 60(2): 133-138. |
| [21] | Heinle H, Hagelauer D, Pascht U, et al. Intestinal spasmolytic effects of STW 5 (Iberogast) and its components [J]. Phytomedicine, 2006, 13(5): 75-79. |
| [22] | Cahlíková L, Opletal L, Kurfürst M, et al. Acetyl-cholinesterase and butyrylcholinesterase inhibitory compounds from Chelidonium majus (Papaveraceae) [J]. Nat Prod Commun, 2010, 5(11): 1751-1754. |
| [23] | Hiller K O, Ghorbani M, Schilcher H. Antispasmodic and relaxant activity of chelidonine, protopine, coptisine, and Chelidonium majus extracts on isolated guinea-pig ileum [J]. Planta Med, 1998,64(8): 758-760. |
| [24] | Paul A, Das J, Das S, et al. Poly (lactide-co-glycolide) nano-encapsulation of chelidonine, an active bioingredient of greater celandine (Chelidonium majus), enhances its ameliorative potential against cadmium induced oxidative stress and hepatic injury in mice [J]. Environ Toxicol Pharmacol, 2013, 36(3): 937-947. |
| [25] | Iagodina O V, Nikol'skaia E B, Faddeeva M D. Inhibition of liver mitochondrial monoamine oxidase activity by alkaloids isolated from Chelidonium and Macleaya and by their derivative drugs [J]. Tsitologiia, 2003, 45(10): 1032-1037. |
| [26] | Iagodina O V. Comparative substrate-inhibitor analysis of liver monoamine oxidases of minks [J]. Zh Evol Biokhim Fiziol, 2010, 46(5): 380-386. |
| [27] | Basova I N, Iagodina O V. The reactivity of liver monoamine oxidase in the ringed seal Phoca hispida ladogensis [J]. Zh Evol Biokhim Fiziol, 2013, 49(2): 105-110. |
| [28] | 季宇彬. 天然药物有效成分药理与应用 [M]. 北京: 科学出版社, 2007: 119-120. |
| [29] | Koriem K M, Arbid M S, Asaad G F. Chelidonium majus leaves methanol extract and its chelidonine alkaloid ingredient reduce cadmium-induced nephrotoxicity in rats [J]. J Nat Med, 2013, 67(1): 159-167. |
| [30] | Park J E, Cuong T D, Hung T M, et al. Alkaloids from Chelidonium majus and their inhibitory effects on LPS-induced NO production in RAW264.7 cells [J]. Bioorg Med Chem Lett, 2011, 21(23): 6960-6963. |
| [31] | 刘 拉. 白屈菜提取工艺的初步研究 [J]. 广东微量元素科学, 2001, 8(7): 55-58. |
| [32] | 程睿波, 陈 旭, 刘淑杰, 等. 白屈菜提取物抑制变形链球菌的实验研究 [J]. 上海口腔医学, 2006, 15(3): 318-320. |
| [33] | 季宇彬. 中药有效成分药理与应用 [J]. 哈尔滨: 黑龙江科学技术出版社, 2004: 108-110. |
| [34] | Vavrecková C, Gawlik I, Müller K. Benzophenanthridine alkaloids of Chelidonium majus; II. Potent inhibitory action against the growth of human keratinocytes [J]. Planta Med, 1996, 62(6): 491-494. |
| [35] | Yao J Y, Zhou Z M, Pan X Y, et al. In vivo anthelmintic activity of chelidonine from Chelidonium majus L. against Dactylogyrus intermedius in Carassius auratus [J]. Parasitol Res, 2011, 109(5): 1465-1469. |
| [36] | 曾建德. 白屈菜碱对敌百虫/氧化乐果防治棉铃虫的增效作用 [J]. 邵阳学院学报: 自然科学版, 2007, 4(4): 93-94. |
| [37] | Staniszewski A, Slesak B, Kołodziej J, et al. Lymphocyte subsets in patients with lung cancer treated with thiophosphoric acid alkaloid derivatives from Chelidonium majus L. (Ukrain) [J]. Drugs Exp Clin Res, 1992, 18(Suppl): 63-67. |
| [38] | Kadan P, Korsh O B, Melnyk A. Ukrain therapy of recurrent breast cancer with lung metastases (case report) [J]. Drugs Exp Clin Res, 1996, 22(3/5): 243-245. |
| [39] | Uglyanitsa K N, Nechiporenko N A, Nefyodov L I, et al. Results of Ukrain monotherapy of prostate cancer [J]. Drugs Exp Clin Res, 2000, 26(5/6): 191-193. |
| [40] | Zemskov V, Prokopchuk O, Susak Y, et al. Efficacy of ukrain in the treatment of pancreatic cancer [J]. Langenbecks Arch Surg, 2002, 387(2): 84-89. |
| [41] | Joubert A, Lottering, M-L, Panzer A. Influence of chelidonine, an inhibitor of tubulin polymerisation on tyrosine kinase activity in normal, transformed and malignant cell lines [J]. Biomed Res, 2004, 25(1): 27-33. |
| [42] | Panzera A, Joubert Anna M, Bianchi P C, et al. The effects of chelidonine on tubulin polymerisation, cell cycle progression and selected signaltransmission pathways [J]. Eur J Cell Biol, 2001, 80(1): 111-118. |
| [43] | El-Readi M Z, Eid S, Ashour M L, et al. Modulation of multidrug resistance in cancer cells by chelidonine and Chelidonium majus alkaloids [J]. Phytomedicine, 2013, 20(3/4): 282-294. |
| [44] | Gagliano N, Moscheni C, Torri C, et al. Ukrain modulates glial fibrillary acidic protein, but not connexin 43 expression, and induces apoptosis in human cultured glioblastoma cells [J]. Anticancer Drugs, 2007, 18(6): 669-676. |
| [45] | 孙 燕. 肿瘤靶向治疗的进展 [J]. 临床药物治疗杂志, 2006, 4(2): 4-12. |
| [46] | Gagliano N, Moscheni C, Torri C, et al. Effect of ukrain on matrix metalloproteinase-2 and secreted protein acidic and rich in cysteine (SPARC) expression in human glioblastoma cells [J]. Anticancer Drugs, 2006, 17(2): 189-194. |
 2014, Vol. 29
2014, Vol. 29


