2. 天津药物研究院 天津市新药设计与发展重点实验室, 天津 300193;
3. 天津大学, 天津 300072
2. Tianjin Key Laboratory of Molecular Design and Drug Discovery, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. Tianjin University, Tianjin 300072, China
银屑病是一种慢性免疫介导的炎性皮肤病,伴有复发性及波动性[1],影响着世界2%的人口,斯堪的纳维亚半岛就有2%~4%的人患有银屑病[2],临床症状表现为增厚性鳞屑斑,这些鳞屑斑会引起全身性疼痛、局部钝痛及皮肤瘙痒[3]。皮疹形式可有点滴状、钱币状、地图状、混合状等多种类型,但界限明显[4]。患病男女在数量上没有明显区别且在任何年龄段上都有患病可能[5]。生活压力和心里压力等因素均会对银屑病的发生发展产生显著影响[6]。银屑病患者的生活质量要低于普通人,而且他们同时并发多种疾病的风险也会有所增加[7, 8, 9]。大部分患者对银屑病缺乏认识,他们对于治疗常常表示不满,且难以坚持药物治疗[10, 11]。由此可见,银屑病严重危害患者的身体健康,寻找治疗银屑病的有效药物具有非常重要的意义。目前用于治疗银屑病的药物种类很多,由于其作用机制的复杂性,银屑病治疗药物的靶点也相继涌现出来,使靶向治疗银屑病得以迅猛发展。近5年来主要以核激素受体的配体,如维生素D受体以及各种与银屑病发病机制有关的分子水平通路上相关的酶和细胞因子为靶点进行药物研究,而小分子药物因其高效、安全、成本低、稳定性好,可以顺利地进入血脑屏障等优势,更是作为新药研发的一个方向,因此本文以作用靶点为分类原则对治疗银屑病的小分子药物进行了综述。
1 维生素D受体激动剂能够结合并激活类固醇核激素受体超家族成员的银屑病治疗药物主要分3类:糖皮质激素、维甲酸和维生素D3类似物。然而,由于全身性副作用,除了视黄醇,这些药物在银屑病中的使用仅限于局部应用[12]。临床上的糖皮质激素类药物和细胞毒免疫抑制剂虽能很好控制症状,但往往有严重的不良反应,且容易复发。近年来,维生素D3类似物是科研人员研究的重点。1,25-二羟维生素D3是维生素D3的活化形式,会与核内维生素D受体结合。角质形成细胞和真皮成纤维细胞中含有1,25-二羟维生素D3受体,1,25-二羟维生素D3是表皮细胞分化的强效刺激剂,而表皮细胞分化会抑制角质形成细胞的增殖,所以维生素D受体的配体药物即维生素D受体激动剂可达到治疗银屑病的目的。
1.1 维生素D受体完全激动剂在针对骨质疏松病患者使用口服的1α-羟基维生素D3进行临床研究的过程中,第一次提出1α-羟基维生素D3可能对银屑病的治疗也有效果[13]。然而,由于口服维生素D3会引起高血钙症的副作用而限制了它的使用。
Agnieszka等[14]通过对1,25-二羟维生素D3的烷基侧链进行缩短优化,得到了一系列化合物,其中以化合物1和2活性最佳。相比于天然配体1,25-二羟维生素D3,虽然化合物1和2在与受体的亲和力和对细胞的诱导以及酶的转录上均没有天然配体1,25-二羟维生素D3的活性好,但数据显示它们基本处于一个数量级,见表 1。化合物1和2也具有较高的细胞活性和转录结合效力,更重要的是,此类化合物不会引起血钙浓度升高,表明这类化合物很可能对银屑病的治疗有效,此类化合物目前还未进入临床研究,是具有很大开发潜力的小分子实体。
| 表 1 维生素D类似物的维生素D受体亲和力、HL-60分化活性及酶转录活性 Table 1 VDR binding properties, HL-60 differentiating activities and transcriptional activities of vitamin D analogues |
近几年,科学研究发现,维生素D类似物作为药物使用时没必要是完全激动剂,而应该设计出具有选择性的维生素D受体部分激动剂,从而改善血钙过多症状。这样的化合物可能可以改变受体H12区的高螺旋构象,从而具有部分的拮抗或激动活性,为维生素D受体药物的选择性研究提供了方向[15]。这一构思与其他一些核激素受体调节剂有类似之处,如选择性雌激素受体调节剂和选择性孕激素受体调节剂[16, 17, 18]。基于这一思路,Kudo等[15]对维生素D的侧链进行修饰,得到了一系列侧链上连有三键和金刚烷环的化合物ADTK1、ADTK2、ADTK3和ADTK4。这些化合物在不同细胞的基因表达中表现出明显的选择性,如ADTK1在肾、肠和骨骼中对CYP24A1的表达活性分别是天然激素1的1、1/2、1/3倍。同样地,ADTK3在肾、骨和单核细胞U937中对CYP24A1的表达选择性大约是天然激素1的50%,但在皮肤和肠细胞中的表达仅为13%、19%。把维生素D侧链的23位连上三键和金刚烷环可能是这类化合物具有高选择性的原因所在。它们均表现出了对维生素D受体的高亲和性(最大可达到90%),且都具有部分激动活性(在40%~80%的有效性下,EC50值可达到1×10−9~1×10−8 mol/L)。目前正在进行该类药物的体内活性测试,进一步确定其在不同基因中的表达选择性以及对钙浓度的影响。
Anami等[19]通过使用22(S)-烷基维生素D类似物研究了维生素D受体激动和拮抗的结构基础,进而设计并合成了一系列具有生物活性的22(R)-烷基维生素D类似物,并通过X射线晶体学分析了维生素D受体与配体结合域与这一系列22(R)-烷基类似物的结合情况,分析出维生素D受体中既存在激动结合域的构象又存在拮抗结合域的构象,而设计得到的22(R)-丁基维生素D类似物是一类具有维生素D受体拮抗活性和部分维生素D受体激动活性的小分子药物,最后作用的总和表现为部分激动活性。经筛选发现了维生素D受体的部分激动剂化合物3,其IC50值为0.29 nmol/L。目前22(R)-烷基维生素D类似物处于临床前体外试验阶段,但这是第一篇利用单晶描述核受体与配体结合构象的研究报道,也为后续针对维生素D受体部分激动剂小分子药物的研究指明了方向,这类药物具有很大的研究价值和开发潜力。
主要维生素D受体激动剂的结构见图 1。
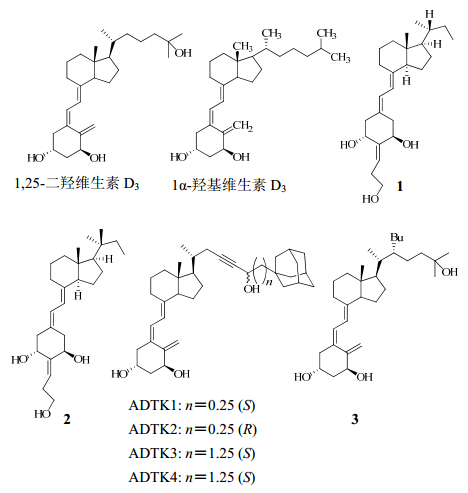 | 图 1 主要维生素D受体激动剂的结构Fig. 1 Structures of main vitamin D receptor agonists |
由于维甲酸已被证实是全身性治疗银屑病的有效药物,因此内源性维甲酸分解的抑制剂就成为了一种替代性治疗药物。维甲酸经过依赖细胞色素P450酶的途径代谢为4-羟基视黄酸和4-氧代视黄酸,这些代谢产物再进一步由葡萄糖醛酸化修饰,最后快速被消除。因此,抑制细胞色素P450酶就会降低维甲酸的分解,从而达到治疗银屑病的目的。作为提示,与维甲酸代谢有关的酶可能成为银屑病治疗药物的新靶点。研究发现,在维甲酸的代谢中发挥重要作用的除了细胞色素P450酶外,还有一个重要的酶是细胞色素P26酶。细胞色素P26酶已成为维甲酸抑制剂发展道路上的又一个有效的作用靶点[20]。
细胞色素P450酶抑制剂利阿唑对细胞色素P26的抑制作用较弱,因此开发了另一个目前已应用于临床的药物他拉罗唑,相比于以前所合成的维甲酸代谢抑制剂,他拉罗唑治疗银屑病的效果良好,且副作用较小[21]。后又发现了化合物R116010,是个强效且选择性的维甲酸代谢酶细胞色素P26酶抑制剂,在神经母细胞瘤的体外和体内实验中均能抑制全反式维甲酸的代谢,但对它的临床发展目前并无进一步的介绍。Gomaa等[20]对与血红素相结合的氮唑环和C3侧链进行修饰得到了一系列具有细胞色素P26抑制活性的化合物,他们的IC50值均小于50 nmol/L,活性均优于R116010。经筛选确定三氮唑甲基酯衍生物化合物(4)为最优化合物,针对细胞色素P26的IC50值为0.35 nmol/L,而利阿唑和R116010的IC50值分别为540 、10 nmol/L。化合物4的选择性是细胞色素家族中其他酶CYPs 1A2、2C9、2C19、2D6的6 000倍以上,有效性是R116010的400倍以上,并且在肝脏中的代谢更加稳定。目前此系列化合物尚处于临床前研究阶段,为具有研究价值的小分子实体系列。
主要细胞色素P26酶抑制剂的结构见图 2。
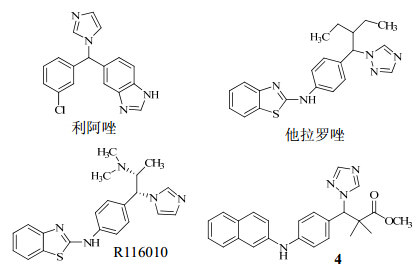 | 图 2 主要细胞色素P26酶抑制剂的结构Fig. 2 Structures of main cytochrome P26 enzyme inhibitors |
p38α促细胞分裂原活化蛋白激酶抑制剂是促细胞分裂原活化蛋白激酶家族的成员之一,是一种丝氨酸/苏氨酸蛋白激酶。其在肿瘤坏死因子、白细胞介素-1β等细胞因子的生成中起到重要作用。许多年来,单核细胞源性的肿瘤坏死因子-α一直被认为是银屑病关节炎和银屑病中的主要免疫调节剂[22]。在皮肤中,抗肿瘤坏死因子-α的治疗能恢复正常表皮角质形成细胞的分化过程,同时可改善表皮过度增生的情况。因此抑制p38α促细胞分裂原活化蛋白激酶抑制剂,可以减少肿瘤坏死因子-α的表达。p38α促细胞分裂原活化蛋白激酶抑制剂已成为治疗银屑病药物的新靶点。
Baur等[23]从一系列二苯并氧杂环环庚烯的化合物中,筛选出化合物5,其结构见图 3。它在人类全血的p38酶试验中表现出了优秀的抑制活性,IC50值低达1.6 nmol/L,抑制肿瘤坏死因子-α释放的IC50值为125 nmol/L,更令人惊喜的是,它具有很低的ATP竞争性,且选择性高、代谢稳定。目前这一系列化合物以大鼠为对象正在进行药动学研究,是具有发展前景的小分子实体。
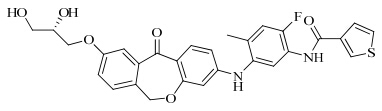 | 图 3 化合物5的结构Fig. 3 Structure of compound 5 |
蛋白激酶C能调节正常角质细胞的生长和分化,而当蛋白激酶C调节失衡时,银屑病患者会出现炎症及角质细胞的异常分化。
星形孢菌素(IC50值为7 nmol/L)属于天然吲哚咔唑类药物,是最有效的蛋白激酶C抑制剂之一,且尚未申报,但因为它对依赖环腺苷酸激酶和蛋白酪氨酸激酶均有抑制作用,所以是个非选择性抑制剂。为了提高对蛋白激酶C的选择性,设计并合成了一系列星形孢菌素衍生物。SCH 47112就是新合成的吲哚咔唑类药物,在体外抑制蛋白激酶C的IC50值为1.7 nmol/L。构效关系研究表明如果对SCH 47112酰胺上的氮进行取代会导致抑制活性的完全丧失,而改变“南面”区域的基团会使耐受性有所提高。经过研究发现了sotrastaurin IC50值为1.0~6.2 nmol/L,是一种强效的选择性蛋白激酶C抑制剂[24]。目前,sotrastaurin已被单独用于银屑病的治疗,同时可与其他免疫抑制剂联合应用于肾移植排异反应。目前正在进行Ⅱ期临床试验,探究其对T细胞依赖性自身免疫性疾病的作用[25]。
主要蛋白激酶C抑制剂的结构见图 4。
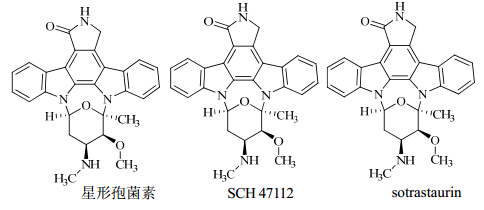 | 图 4 主要蛋白激酶C抑制剂的结构Fig. 4 Structures of main protein kinase C inhibitors |
JAK激酶是一个细胞内非受体酪氨酸激酶家族,介导细胞因子产生的信号,并通过JAK-STAT信号通路传递下去。在癌症以及一些非恶性疾病如银屑病中,会发现被配体激活的蛋白酪氨酸激酶过度活化或过度表达。许多蛋白酪氨酸激酶是生长因子如表皮生长因子受体的受体,或是与生长因子的信号转导途径有关,还有一些参与血管生成的调控和免疫应答。所以JAK激酶可作为银屑病治疗药物的靶点。JAK激酶家族共有4个成员,分别是JAK激酶1(JAK1)、JAK激酶2(JAK2)、JAK激酶3(JAK3)和酪氨酸激酶2(TYK2)。
5.1 以JAK1、JAK2和JAK3为靶点的抑制剂美国辉瑞公司研发的JAK抑制剂托法替尼能有效地选择抑制JAK3,同时对JAK1、JAK2也有抑制作用,从而在细胞因子水平异常的体系中阻断JAKs介导的一系列细胞因子信号通路,抑制异常免疫信号的传导。其对JAK1、JAK2、JAK3的IC50值分别为3.2、4.1、1.6 nmol/L,且在细胞实验中选择性抑制JAK3的能力比JAK2高10倍以上[26]。目前作为抗类风湿性关节炎的药物已上市,而作为银屑病及抗移植排斥的药物正处于临床III期研究阶段[27]。
美国礼来公司和Incyte公司正在开发新一代小分子JAK1和JAK2激酶抑制剂baricitinib,其是治疗类风湿关节炎、银屑病和其他炎性疾病以及糖尿病性肾病的潜在口服小分子药物。它的药物化学发现至今未在文献中有过报道,但是类似于托法替尼,baricitinib也是以吡咯并杂环作为药效团,而且可能与JAKs以相同的活性位点结合[28, 29]。在临床前研究的酶试验中,对JAK1、JAK2、JAK3和TYK2这4种激酶的IC50值分别为4.0、6.6、787.0、61.0 nmol/L。不同于托法替尼,baricitinib对JAK1和JAK2的抑制活性要强于JAK3,其作用选择性分别高于JAK3、TYK2的70、10倍。目前正处于临床Ⅲ期研究阶段,采用每天给药一次的药物治疗方案,仍需要后续观察报道[30]。
近几年,发现了一系列大环类小分子化合物可以选择性抑制酪氨酸激酶家族中的JAK2和FMS样酪氨酸激酶3(Ⅲ型受体酪氨酸激酶的一种)。其中以具有高度溶解性的化合物6为最优。它在关节炎小鼠模型中的口服效用证明其在自身免疫性和炎症性疾病中有治疗作用,尤其是银屑病和类风湿性关节炎。化合物6对JAK2的IC50为46 nmol/L,对JAK2的选择性分别是周期蛋白依赖性激酶2、JAK1、JAK3的152、58、93倍。它对FMS样酪氨酸激酶3的抑制浓度与JAK2相似,且选择性是TYK2的5倍。化合物6目前正处于健康受试者的Ⅰ期临床试验阶段[31]。
5.2 以TYK2为靶点的抑制剂研究发现,TYK2抑制剂会抑制IL-12的体内途径,而早前抗IL-12的一个亚基p40的抗体优特克单抗已通过FDA的批准用于治疗银屑病[32]。所以特异性地以TYK2为靶点也是目前研究抗银屑病小分子药物的一个方向。有研究人员以化合物7(抑制常数Ki=4.8)作为先导化合物进行优化设计,合成了一系列更有效、选择性更好且具有口服生物利用度的TYK2抑制剂,经过筛选得到最优化合物8(Ki=1.6)[33],目前正处于临床前研究阶段,是一类具有开发潜力的小分子实体。
主要JAK激酶抑制剂的结构见图 5。
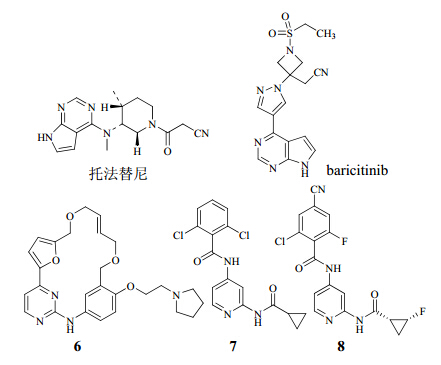 | 图 5 主要JAK激酶抑制剂的结构Fig. 5 Structures of main JAK kinase inhibitors |
磷酸二酯酶-4是一种可以降解第二信使cAMP的细胞内酶,在免疫系统的细胞,如树突细胞、单核细胞、中性粒细胞以及角质细胞中均有所表达。磷酸二酯酶-4能调节cAMP的量以及下游的炎症信号传导的级联反应[34, 35],对于促炎细胞因子的产生起关键调节作用,磷酸二酯酶-4靶向抑制剂用于治疗慢性炎症性疾病,像银屑病和银屑病关节炎等,是临床上一种新颖的治疗途径。
前期研究发现乙酰氨基取代的邻苯二甲酰亚胺类似物对磷酸二酯酶-4具有特异的抑制作用,其中化合物阿普司特作为磷酸二酯酶-4和TFN-α双重抑制剂,是一种口服药物,抑制参与银屑病发病机制中的多个炎症标志物的活性[36],其结构见图 6。在临床前研究的酶试验中,对磷酸二酯酶-4和TFN-α的IC50值分别为0.077、0.074 μmol/L。在两组大鼠炎症模型研究中,阿普司特表现出了良好的药动学特性和口服有效性。目前正处于临床Ⅲ期研究阶段[37],Ⅲ临床试验显示,阿普司特与其他口服制剂合用,安全性良好,副反应较小。截止目前为止,全球已有9个试验点正在进行Ⅲ期临床试验。
 | 图 6 阿普司特的结构Fig. 6 Structure of apremilast |
研究表明,银屑病属于自体免疫性疾病。因此参与免疫系统信号应答的各种免疫细胞及细胞因子可能是治疗银屑病的关键所在。
7.1 阻断白细胞黏附的新药白细胞黏附是免疫应答中的重要环节,Michael Albeck的实验室以此为靶点设计了一个新的无机小分子,以非金属元素碲(Te)配位的化合物AS101[38]。AS101中的碲可与巯基结合,从而改变某些特定蛋白质中氨基酸残基上的巯基或二硫键的构象,引起蛋白质失活从而失去生物活性,实验证实AS101可以特异性地使半胱氨酸蛋白酶失活。许多白细胞受体中都存在此类蛋白,所以AS101可以有效减少白细胞黏附,许多体内试验已经证实AS101可以向下调节IL-1β、IL-17、IL-6的分泌水平,达到抗炎的目的。AS101目前正处于临床Ⅱ期试验阶段,在双盲临床试验中,AS101能显著改善患者银屑病表皮面积和严重指数。在试点研究中,对3个接受AS101 8周治疗的患者进行组织活检,发现AS101能显著减少IL-17A和IL-16的表达,与对照组相比还能减少IL-17A蛋白的分泌水平,是一个具有发展前景的新型小分子药物。
7.2 鞘氨醇-1磷酸受体拮抗剂鞘氨醇-1-磷酸是一种溶血磷脂,其活性通过5个G蛋白偶联的鞘氨醇-1-磷酸受体来调节,鞘氨醇-1-磷酸可以诱导产生T淋巴细胞并使其从次级淋巴组织进入循环系统,发挥免疫调节功能。因此,鞘氨醇-1-磷酸已成为治疗银屑病的一个新靶点。
由Actelion公司开发的ponesimod是一个选择性的鞘氨醇-1-磷酸受体拮抗剂,作用于鞘氨醇-1-磷酸表面从而阻断T淋巴细胞循环[39]。ponesimod目前正处于Ⅱ期临床研究阶段,是第一个可口服的具有选择性和可逆性的鞘氨醇-1-磷酸受体调节剂,用于治疗中重度慢性斑块型银屑病。在Ⅱ期临床试验中,对326名患者进行为期16周的观察,病情明显有所改善,但仍会出现呼吸困难,肝酶浓度升高和头晕等副作用,目前仍在进行后期观察治疗[40, 41]。
7.3 其他免疫信号因子抑制剂由北京大学人民医院研发的Ⅰ类新药benvitimod,是一种非甾体的小分子抗炎药物[42],最初来源于昆虫病原线虫的代谢物,能有效的抑制IFN-γ、IL-2和TNF-α的表达,阻止外周血单核细胞向白三烯B4的迁移同时还能抑制T细胞的炎性浸润。作为外用乳膏剂,目前在中国和加拿大都已进入银屑病的临床研究阶段,在国内已对健康受试者进行了临床Ⅰ期的随机、双盲、对照评估试验,结果显示剂量达到30 mg时,受试者耐受性依然良好,且副作用温和,适合于局部应用。
主要免疫细胞抑制剂的结构见图 7。
 | 图 7 主要免疫细胞抑制剂的结构Fig. 7 Structures of main immune cell inhibitors |
紫檀是商业可获得的天然拉帕醌类物质,原产于亚马逊雨林的蚁树内树皮。在南美有很长一段时间在民间用于治疗恶性肿瘤、炎症、感染、胃病和皮肤病[43, 44]。如今,此类药物被誉为治疗癌症的神奇药物,同时也可用来治疗免疫系统的疾病,如银屑病。
已证明有抗银屑病临床作用的三环类抗增殖剂有蒽酚类衍生物(9)和呋喃并苯并吡喃酮类衍生物(10)。银屑病的一大特点就是角质形成细胞的过度增殖,而拉帕醌类衍生物恰恰可作为角质形成细胞过度增殖的抑制剂。经优化研究发现,与传统的抗银屑病药物9相比,最有效同时也是毒性最强的是化合物10。这些研究结果都进一步证实了拉帕醌类衍生物在银屑病和其他过度增殖的皮肤病治疗中有一定的发展前景[45],目前还没有临床研究资料的报道,但却是值得进一步研究开发的小分子实体。
9 结语银屑病是一种炎性皮肤疾病,由于其作用机制的复杂性,可以从已有活性的药物入手,寻找新的靶点,或将已有靶点的药物相互结合设计出多靶点药物,从而研发出特异性更强、副作用更小、依从性更好,同时又能有效治疗银屑病的新型小分子药物。如果这些靶向药物研制成功还将能应用于其他过度增生性和炎性疾病,如关节炎、炎性肠胃病和癌症等。此外,易感基因理论和心血管生成理论正在研究中,为银屑病药物的发展提供了新的思路和方向。鉴于有机小分子化合物高效、安全、成本低和稳定等优点,通过建立高效和特异的筛药模型筛选有机小分子化合物已成为新药研制领域的一项重要课题,因此小分子抗银屑病药物依然是市场需求的导向。
| [1] | Larsen M H, Hagen K B, Krogstad A L, et al. Limited evidence of the effects of patient education and selfmanagement interventions in psoriasis patients: A systematic review [J]. Patient Educ Couns, 2014, 94(2): 158-169. |
| [2] | Parisi R, Symmons D P, Griffiths C E, et al. Global epidemiology of psoriasis: a systematic review of incidence and prevalence [J]. J Invest Dermatol, 2013, 133(2): 377-385. |
| [3] | Ljosaa T M, Mork C, Stubhaug A, et al. Skin pain and skin discomfort is associated with quality of life in patients with psoriasis [J]. Eur Acad Dermatol Venereol, 2012, 26(1): 29-35. |
| [4] | 康景华, 李正翔, 刘宏祥. 凉血化斑颗粒治疗常见皮肤病500例临床观察 [J]. 中草药, 2007, 38(4): 586-587. |
| [5] | National Clinical Guideline Centre. Psoriasis: assessment and management of psoriasis [OL]. [2014-09-01]. http://www.nice.org.uk/guidance/cg153/resources/guidance-psoriasis-pdf. |
| [6] | Basavaraj K H, Navya M A, Rashmi R. Stress and quality of life in psoriasis: an update [J]. Int J Dermatol, 2011, 50(7): 783-792. |
| [7] | Kim N, Thrash B, Menter A. Comorbidities in psoriasis patients [J]. Sem Cutan Med Surg, 2010, 29(3): 10-15. |
| [8] | Prey S, Paul C, Bronsard V, et al. Cardiovascular risk factors in patients with plaque psoriasis: a systematic review of epidemiological studies [J]. Eur Acad Dermatol Venereol, 2010, 24(Suppl 2): 23-30. |
| [9] | Kimball A B, Guérin A, Tsaneva M, et al. Economic burden of comorbidities in patients with psoriasis is substantial [J]. J Eur Acad Dermatol Venereol, 2011, 25(5): 157-163. |
| [10] | Renzi C, Di Pietro C, Tabolli S. Participation, satisfaction and knowledge level of patients with cutaneous psoriasis or psoriatic arthritis [J]. Clin Exp Dermatol, 2011, 36(8): 885-888. |
| [11] | Maguire S. Improving adherence in psoriasis [J]. Independent Nurse, 2014, 2010(11): 34-35. |
| [12] | Conigliaro P, Scrivo R, Valesini G, et al. Emerging role for NK cells in the pathogenesis of inflammatory arthropathies [J]. Autoimmun Rev, 2011, 10(10): 577-581. |
| [13] | Morimoto S, Kumahara Y. A patient with psoriasis cured by 1 alpha-hydroxyvitamin D3 [J]. Med J Osaka Univ, 1985, 35(10): 51-54. |
| [14] | Glebocka A, Sicinski R R, Plum L A, et al. Synthesis and biological activity of 2-(3'-hydroxypropylidene)-1α-hydroxy-19-norvitamin D analogues with shortened alkyl side chains [J]. J Med Chem, 2011, 54(4): 6832-6842. |
| [15] | Kudo T, Ishizawa M, Maekawa K, et al. Combination of triple bond and adamantane ring on the vitamin D side chain produced partial agonists for vitamin D receptor [J]. J Med Chem, 2014: 57(10): 4073-4087. |
| [16] | 宋东伟, 徐 斌, 王玉姝, 等. 选择性雌激素受体调节剂组织选择性作用研究进展 [J]. 现代药物与临床, 2014, 29(2): 206-210. |
| [17] | Lusher S J, Raaijmakers H C, Vu-Pham, D, et al. X-ray structures of progesterone receptor ligand binding domain in its agonist state reveal differing mechanisms for mixed profiles of 11β-substituted steroids [J]. J Biol Chem, 2012, 287(24): 20333-20343. |
| [18] | Lusher S J, Raaijmakers H C, Vu-Pham D, et al. Structural basis for agonism and antagonism for a set of chemically related progesterone receptor modulators [J]. J Biol Chem, 2011, 286(8): 35079-35086. |
| [19] | Anami Y, Itoh T, Egawa D, et al. A mixed population of antagonist and agonist binding conformers in a single crystal explains partial agonism against vitamin D receptor: active vitamin D analogues with 22R-alkyl group [J]. J Med Chem, 2014, 57(10): 4351-4367. |
| [20] | Gomaa M S, Bridgens C E, Veal G J, et al. Synthesis and biological evaluation of 3-(1H-imidazol-and triazol-1-yl)-2,2-dimethyl-3-[4-(naphthalen-2-ylamino)phenyl]propyl derivatives as small molecule inhibitors of retinoic acid 4-hydroxylase (CYP26) [J]. J Med Chem, 2011, 54(5): 6803-6811. |
| [21] | Geria A N, Scheinfeld N S. Talarazole, a selective inhibitor of P450-mediated all-trans retinoic acid for the treatment of psoriasis and acne [J]. Curr Opin Invest Drugs, 2008, 9(11): 1228-1237. |
| [22] | Yoo I S, Lee J H, Song S T, et al. T-helper 17 cells: the driving force of psoriasis and psoriatic arthritis [J]. Int J Rheum Dis, 2012, 15(6): 531-537. |
| [23] | Baur B, Storch K, Martz K E, et al. Metabolically stable dibenzo[b,e]oxepin-11(6H)-ones as highly selective p38 MAP kinase inhibitors: optimizing anti-cytokine activity in human whole blood [J]. J Med Chem, 2013, 56(3): 8561-8578. |
| [24] | Weckbecker G, Pally C, Beerli C, et al. Effects of the novel protein kinase C inhibitor AEB071 (sotrastaurin) on rat cardiac allograft survival using single agent treatment or combination therapy with cyclosporine, everolimus or FTY720 [J]. Transpl Int, 2010, 23(5): 543-552. |
| [25] | Wagner J, Matt P, Faller B, et al. Structure-activity relationship and pharmacokinetic studies of sotrastaurin (AEB071), a promising novel medicine for prevention of graft rejection and treatment of psoriasis [J]. J Med Chem, 2011, 54(17): 6028-6039. |
| [26] | Vijayakrishnan L, Venkataramanan R, Gulati P. Treating inflammation with the janus kinase inhibitor CP-690550 [J]. Trends Pharm Sci, 2011, 32(1): 25-34. |
| [27] | 王澳轩, 刘冰妮, 刘 颖, 等. 抑制JAK3激酶的免疫抑制剂托法替尼 [J]. 药物评价研究, 2014, 37(2): 169-172. |
| [28] | Friedman P A, Fridman J S, Luchi M E, et al. Preparation of pyrrolopyrimidine derivatives as Janus kinase inhibitors for treatment of dry eye and other eye related diseases [P]. WO2010039939A1, 2010-04-08. |
| [29] | Rodgers J D, Shepard S, Li Y L, et al. Preparation of azetidine and cyclobutane derivatives as JAK inhibitors [P]. WO2009114512A1, 2009-09-17. |
| [30] | Clark J D, Flanagan M E, Telliez J B. Discovery and development of janus kinase (JAK) inhibitors for inflammatory diseases [J]. J Med Chem, 2014, 57(1): 5023-5038. |
| [31] | William A D, Lee A C-H, Poulsen A, et al. Discovery of the macrocycle (9E)-15-(2-(pyrrolidin-1-yl)ethoxy)-7,12,25-trioxa-19,21,24-triaza-tetracyclo[18.3.1.1(2,5).1(14,18)] hexacosa-1(24),2,4,9,14(26),15,17,20,22-nonaene (SB1578), a potent inhibitor of janus kinase 2/fms-like tyrosine kinase-3 (JAK2/FLT3) for the treatment of rheumatoid arthritis [J]. J Med Chem, 2012, 55(6): 2623-2640. |
| [32] | Benson J M, Sachs C W, Treacy G, et al. Therapeutic targeting of the IL-12/23 pathways: generation and characterization of ustekinumab [J]. Nat Biotechnol, 2011, 29(7): 615-624. |
| [33] | Liang J, Abbema A, Balazs M, et al. Lead optimization of a 4-aminopyridine benzamide scaffold to identify potent, selective, and orally bioavailable TYK2 inhibitors [J]. J Med Chem, 2013, 56(11): 4521-4536. |
| [34] | Schafer P H, Parton A, Gandhi A K, et al. Apremilast, a cAMP phosphodiesterase-4 inhibitor, demonstrates anti-inflammatory activity in vitro and in a model of psoriasis [J]. Br J Pharmacol, 2010, 159(4): 842-855. |
| [35] | McCann F E, Palfreeman A C, Andrews M, et al. Apremilast, a novel PDE4 inhibitor, inhibits spontaneous production of TNF-alpha from human rheumatoid synovial cells and ameliorates experimental arthritis [J]. Arthritis Res Ther, 2010, 12(3): R107. |
| [36] | 赵 倩, 孙 悦, 石 玉, 等. 磷酸二酯酶-4抑制剂阿普司特 [J]. 现代药物与临床, 2014, 29(4): 411-416. |
| [37] | Palfreeman A C, McNamee K E. New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast [J]. Drug Des Devel Ther, 2013, 7: 201-210. |
| [38] | Halpert G, Sredni B. The effect of the novel tellurium compound AS101 on autoimmune diseases [J]. Autoimmun Rev, 2014, 13(12): 1230-1235. |
| [39] | Nakamura T, Asano M, Sekiguchi Y, et al. Synthesis and evaluation of CS-2100, a potent, orally active and S1P(3)-sparing S1P(1) agonist [J]. Eur J Med Chem, 2012, 51: 92-98. |
| [40] | Ryan C, Menter A. Ponesimod—a future oral therapy for psoriasis? [J]. Lancet, 2014, doi:10.1016/S0140-6736(14) 61039-4. |
| [41] | Vaclavkova A, Chimenti S, Arenberger P, et al. Oral ponesimod in patients with chronic plaque psoriasis: a randomised, double-blind, placebo-controlled phase 2 trial [J]. Lancet, 2014, doi:10.1016/S0140-6736(14) 60803-5. |
| [42] | Zhao L, Chen X, Cai L, et al. Randomized, double-blind, placebo-controlled, multiple-dose study of the safety, tolerability and pharmacokinetics of benvitimod, a candidate drug for the treatment of psoriasis [J]. J Clin Pharm Ther, 2014, 39(2): 418-423. |
| [43] | Jones K. Pau d’Arco: Immune Power from the Rain Forest [M]. Rochester: Healing Arts Press, 1995. |
| [44] | Gómez Castellanos J R, Prieto J M, Heinrich M. Red lapacho (Tabebuia impetiginosa)a global ethnopharmacological commodity? [J]. J Ethnopharmacol, 2009, 121(9): 1-13. |
| [45] | Alexandra R, Silke V, Sven B, et al. Synthesis and structure-activity relationships of lapacho analogues. 1. suppression of human keratinocyte hyperproliferation by 2-substituted naphtho[2,3-b]furan-4,9-diones, activation by enzymatic one-and two-electron reduction, and intracellular generation of superoxide [J]. J Med Chem, 2012, 55(10): 7273-7284. |
 2014, Vol. 29
2014, Vol. 29


