苦豆子为豆科槐属多年生草本植物苦豆子Sophora alopecuroides L.的干燥种子,是我国西北地区常用的中药材[1]。《本草纲目》对苦豆子的药用价值有详细的记载,称苦豆子有“清热解毒、抗菌消炎、利尿去火、止痛镇静”等功效。近年来的研究表明,苦豆子具有抗癌、抗病毒、抗炎、免疫等药理活性[2,3,4]。苦豆子多糖的主要成分是半乳甘露聚糖[5],可作为增稠剂、稳定剂、黏合剂广泛应用于食品、医药、造纸等行业。药理研究发现半乳甘露聚糖具有降血糖、调血脂、减肥等功效,近年来已引起了国内外研究人员的广泛关注[6]。由于苦豆子多糖溶液颜色较深,对后面的功能研究存在着较大干扰,因此对苦豆子多糖溶液进行脱色是很有必要的。常用的溶液脱色方法有离子交换法、氧化法、金属络合物法、吸附法等[7]。本实验探讨双氧水(H2O2)法对苦豆子多糖的脱色效果,以期找出最适合苦豆子多糖浸提液的脱色工艺条件,为生产出高品质的苦豆子多糖提供科学依据。 1 材料与仪器
苦豆子于2010年3月购自内蒙古磴口县金豆商贸有限公司,由天津市医药科学研究所天然药化室吴寿金研究员鉴定为豆科槐属植物苦豆子Sophora alopecuroides L.的种子;葡萄糖对照品由中国食品药品检定研究院提供,批号110833-200503;其余试剂均为分析纯。
LXJ—ⅡB型低速大容量多管离心机(北京医用离心机厂);UV—260型紫外仪机(日本岛津公司);Labconco型真空冷冻干燥仪(日本岛津公司);R—202型旋转蒸发器(上海申胜生物技术有限公司);AE—240电子天平(梅特勒-托利多仪器(上海)有限公司);PHS—25型pH计(上海虹益仪器仪表有限公司)。 2 方法与结果 2.1 苦豆子粗多糖的提取[8]
取苦豆子400 g,加入10倍量95%乙醇浸泡30 min后,回流提取两次,每次2 h,滤过。药渣依次加入15、10倍量水提取2 次,每次2 h,滤过,合并总提取液。旋转蒸发浓缩至适当体积后,加入1/4倍Sevag试剂氯仿-正丁醇(4∶1)脱除蛋白,离心分离,反复操作至无蛋白层为止,加入4倍量无水乙醇,4 ℃冰箱中沉淀过夜,离心,沉淀用无水乙醇和丙酮反复洗涤至上清液无色,得沉淀,经冷冻干燥得粗多糖。 2.2 多糖的苯酚-硫酸比色法测定[9] 2.2.1 标准曲线的制备
精密称取105 ℃干燥至恒定质量的葡萄糖对照品100 mg,置于100 mL量瓶中,溶解并稀释至刻度,配成1 mg/mL的对照品贮备液。吸上述贮备液10 mL定容至100 mL,配成0.1 mg/mL葡萄糖对照品溶液。精密移取葡萄糖对照品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL于25 mL具塞刻度试管中,加蒸馏水至1.0 mL,再各加6%苯酚溶液0.5 mL,摇匀,迅速加入浓硫酸5 mL,振摇5 min,置沸水浴中加热10 min,取出冷却至室温。以试剂空白为参比,在490 nm波长处测定吸光度值。以吸光度值为纵坐标,质量浓度为横坐标,得回归方程Y=0.856 4 X-0.003 7,R2=0.999 1,结果表明质量浓度在0~100 μg/mL与吸光度值呈良好的线性关系。 2.2.2 苦豆子多糖的测定
以490 nm波长处的吸光度值带入回归方程计算多糖的含量。
2.2.3 有色物质的测定 对苦豆子粗多糖溶液在可见-紫外光谱700~200 nm波长进行扫描,确定其中有色物质的最大吸收峰。结果表明多糖溶液无最大吸收波长。由于多糖溶液脱色前后均为橙黄色,故根据互补色原理选择450 nm为检测波长[10],以450 nm波长处吸光度值代替有色物质的量。
2.3 指标的确定
双氧水在一定条件下生成原子氧,这种原子氧的活性很强,可以将有机色质内部的“生色团”(实际上是一种特殊的键)破坏掉而使之失去原有的颜色,这种脱色是彻底的、不可逆的。考虑H2O2有较强的氧化性而破坏多糖,故以脱色率和多糖保留率为指标进行考察。
准确配制0.01 g/mL苦豆子粗多糖溶液。分别准确量取10 mL,置于25 mL具塞试管中,加入一定量的30% H2O2,调节pH值,然后在水浴中恒温脱色一定时间,抽滤,滤液稀释后分别在450、490 nm测定吸光度值,计算多糖脱色率和多糖保留率。
脱色率=(A450脱色前-A450脱色后)/A450脱色前×100% 多糖保留率=(A490脱色前-A490脱色后)/A490脱色前×100% 固定其他因素,以脱色率和多糖保留率为指标,进行单因素试验。分别考察双氧水脱色方法中双氧水加入量、脱色时间、脱色温度和pH值中的各因素,研究以上因素对双氧水脱色效果的影响。
2.4.1 双氧水加入量对多糖脱色效果的影响 随着H2O2加入量的增加,多糖脱色率先增大后趋于平稳,多糖保留率则不断下降。当H2O2加入量为1.5%时,多糖具有较高的脱色率和较好的多糖保留率,因此认为1.5%为H2O2的最佳加入量。结果见图 1。
随着脱色时间的延长,多糖脱色率呈波动式增加,而多糖保留率不断下降。当脱色时间为4 h时,多糖脱色率和多糖保留率均相对较高。结果见图 2。
脱色温度小于50 ℃时,多糖脱色率不断递增;脱色温度大于50 ℃时,多糖脱色率和多糖保留率均显著降低。因此脱色温度为50 ℃时,H2O2对多糖脱色效果较好。结果见图 3。
多糖脱色率和多糖保留率均随着溶液pH值的增大而先增加后减小,在pH值为5时,多糖脱色率和多糖保留率具有最大值,此时多糖脱色效果最好。结果见图 4。
在单因素试验的基础上,对影响H2O2脱色的主要因素温度(A)、时间(B)、H2O2加入量(C)和pH值(D)进行L9(34)正交试验设计,从而优化H2O2脱色工艺参数。根据H2O2脱色单因素试验结果,选取各因素水平,按照因素水平设计表 1对影响脱色的主要因素进行L9(34)正交试验。对实验数据采用综合加权评分法评分,权重系数均为0.5,第一项指标将H2O2脱色率的最大数定为100分,第二项指标将保留率的最大数定为100分,其他各组合按综合评分=(脱色率/32.42)×100×0.5+(多糖保留率/78.75)×100×0.5。结果见表 2。
可见各因素对H2O2脱色影响的主次顺序分别为A>B>C>D,即脱色温度>时间>双氧水加量> pH值;最优水平为A3B3C3D2,即温度60℃,时间5 h,H2O2加量2.5%,pH值为5。
为节省原料,缩短时间,提高效率,脱色时间调整为3 h,H2O2加入量为1.0%。故最佳脱色条件为:脱色温度60 ℃条件下,调节pH 5,加入1.0%的H2O2,脱色反应3 h。
2.6 验证试验
准确量取0.01 g/mL苦豆子多糖溶液10 mL于25 mL具塞试管中,按最佳脱色工艺进行3次平行试验,结果多糖脱色率和保留率分别为29.83%、71.12%(n=3)。结果表明,此脱色工艺有效可行。
3 讨论
多糖提取物的脱色方法常用双氧水法。双氧水脱色适用于色素多含有不饱和双键、羟基、芳香环的物质,因此需要目的产物具有稳定性、不易被氧化的特点;但由于双氧水脱色法是直接氧化提取液中的色素,因此双氧水量过高可能会将多糖链状结构破坏,使多糖保留率下降,所以在使用时一定要控制好条件。
双氧水对苦豆子多糖脱色效果明显,最佳脱色条件为:脱色温度60 ℃条件下,调节pH 5,加入1.0%的双氧水,脱色反应3 h,脱色率和多糖保留率分别为29.83%、71.12%。此条件下,既可以使脱色率达到最高,又可以使多糖损失率下降到较低水平,这为生产出高品质的苦豆子多糖提供依据,也为苦豆子多糖工业化生产提供了试验依据。
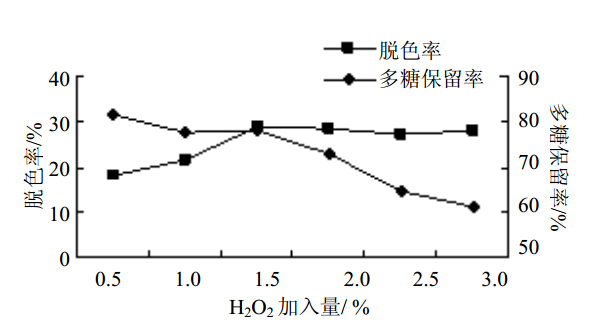
图 1 双氧水加入量对苦豆子多糖脱色效果影响Fig. 1 Effect of H2O2 amountondecolorization of S.alopecuroides polysaccharides 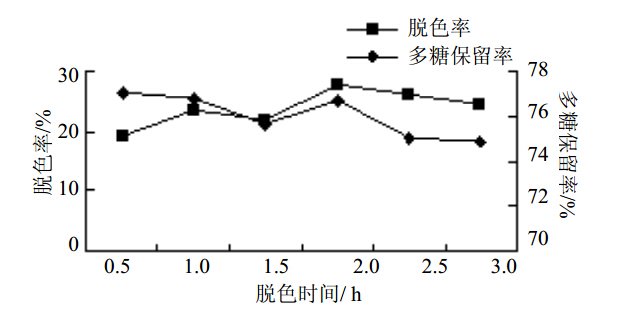
图 2 脱色时间对苦豆子多糖脱色效果影响Fig. 2 Effect of decolorizing time on decolorization of S.alopecuroides polysaccharides 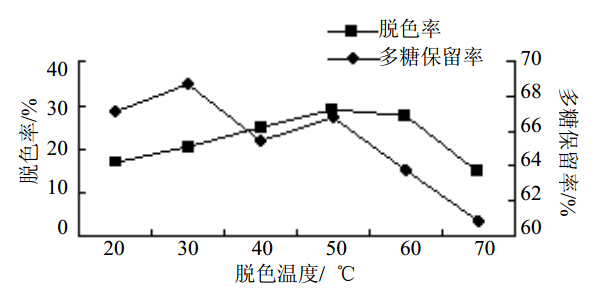
图 3 脱色温度对苦豆子多糖脱色效果影响Fig. 3 Effect of bleaching temperature on decolorization of S. alopecuroides polysaccharides 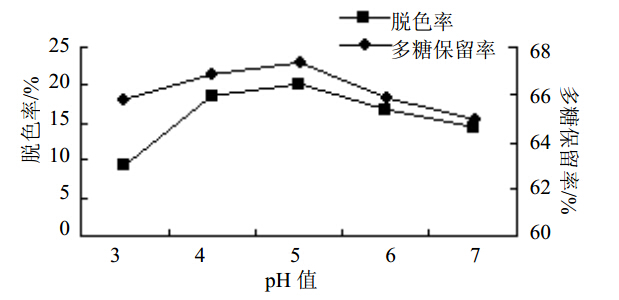
图 4 pH值对苦豆子多糖脱色效果影响Fig. 4 Effect of pH value on decolorization of S. alopecuroides polysaccharides
![]()
表 1 因素水平
Table 1 Factors and levels
![]()
表 2 正交试验设计与结果
Table 2 Design and results of orthogonal test
| [1] | 祁燕蓉, 何生虎, 史光亮. 苦豆子的研究进展 [J]. 甘肃畜牧兽医, 2008(6): 36-38. |
| [2] | 刘 军, 熊元君, 李 勇, 等. 苦豆子研究近况 [J]. 新疆中医药, 2006, 24(6): 60-63. |
| [3] | 周福生, 穆 青. 野生植物苦豆子的化学成分和主要药理作用 [J]. 中国野生植物资源, 2006, 25(4): 1-3. |
| [4] | 廖春燕, 梁 健, 杨 燕, 等. 苦豆子的药理及应用概述 [J]. 中国民族民间医药, 2009(3): 6-8. |
| [5] | 杨永利, 郭守军, 罗军德, 等. 苦豆子胶多糖组分气相色谱与薄层色谱分析 [J]. 食品研究与开发, 2006, 27(11): 159-162. |
| [6] | 蒋建新, 张卫明, 朱莉伟, 等. 半乳甘露聚糖型植物胶的研究进展 [J]. 中国野生植物资源, 2001, 20(4): 1-5. |
| [7] | 付学鹏, 杨晓杰. 植物多糖脱色技术的研究 [J]. 食品研究与开发, 2007, 28(11): 166-169. |
| [8] | 陶遵威, 张 岩, 王文彤. 大孔吸附树脂对苦豆子多糖纯化工艺研究 [J]. 现代药物与临床, 2013, 28(4): 515-518. |
| [9] | 刘 娅, 戴升健, 鲁松涛, 等. 无花果多糖超声提取技术的研究 [J]. 食品科技, 2006(9): 87-89. |
| [10] | 和殿峰, 李跟区, 陈爱娜. 正交试验优选鱼腥草多糖活性炭脱色工艺 [J]. 中国药房, 2009, 20(6): 434-435. |
 2014, Vol. 29
2014, Vol. 29

