2. 沈阳药科大学 中药学院, 辽宁 沈阳 110016
2. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
水黄皮Pongamia pinnata (Linn.) Pierre为豆科水黄皮属唯一一种植物,茎部光滑无毛,广泛分布于东南亚国家的河堤与沿海地区,最早发现于印度森林的潮汐地,别名印度鱼藤[1],是一种极其具有药用价值的木本植物。在传统用药中,水黄皮的种子油可以用于治疗瘙痒、脓疮和其他皮肤类疾病;花用来治疗糖尿病;根部用于治疗出血性痔疮、脚气病、糖尿病和抗菌[2, 3]。水黄皮药效成分主要是黄酮类和油脂类。
2003年黄欣碧等[4]总结了水黄皮的化学成分及药理作用研究进展,本文梳理了2004—2014年水黄皮的化学成分和药理作用,并补充了2003年之前未综述的研究工作,为其药效物质基础研究、作用机制研究及开发利用提供理论依据。
1 化学成分目前从水黄皮的种子、叶子、花、树皮、茎皮及心材等部位分离得到160多个化合物,主要有黄酮类、三萜类、生物碱类、氨基酸等成分。
1.1 黄酮类 1.1.1 黄酮水黄皮中的主要化学成分是黄酮类成分,迄今为止从水黄皮中分离得到60多个黄酮。水黄皮中的黄酮类成分根据所含取代基种类及位置的不同可以分为角型呋喃黄酮(1~20)、线型呋喃黄酮(21~24),角型吡喃黄酮(25~30)和其他黄酮(31~45)。从水黄皮中分离得到的黄酮类化合物见表 1,结构见图 1。
| 表 1 从水黄皮中分离得到的黄酮类化合物 Table 1 Flavonoid compounds isolated from P. pinnata |
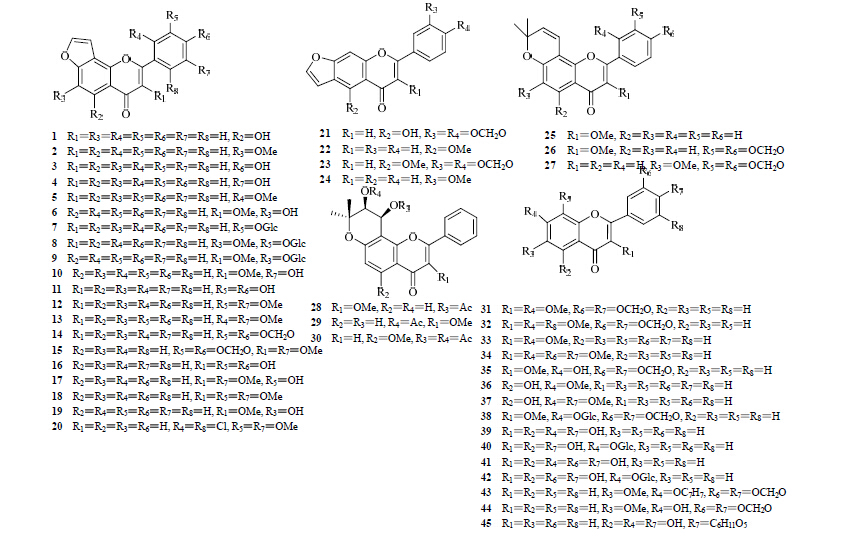 | 图 1 从水黄皮中分离得到的黄酮类化合物的结构Fig. 1 Structures of flavonoid compounds isolated from P. pinnata |
目前从水黄皮中分离得到16个二氢黄酮类化合物。水黄皮中的二氢黄酮包括呋喃二氢黄酮(46~48)、吡喃二氢黄酮(49~51)和其他二氢黄酮(52~54)。目前从水黄皮中分离得到的二氢黄酮类化合物见表 2,结构见图 2。
| 表 2 从水黄皮中分离得到的二氢黄酮类化合物 Table 2 Dihydroflavonoid compounds isolated from P. pinnata |
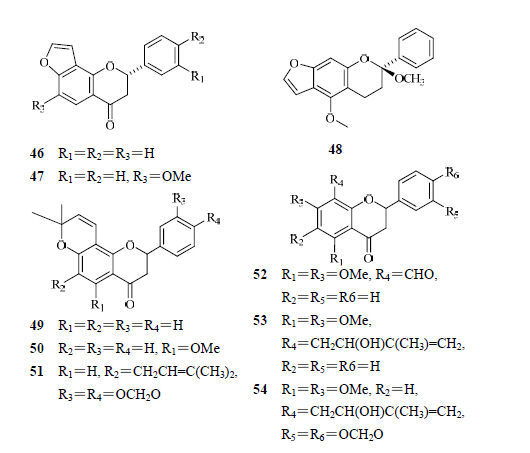 | 图 2 从水黄皮中分离得到的二氢黄酮类化合物的结构Fig. 2 Structures of dihydroflavonoid compounds isolated from P. pinnata |
目前从水黄皮中共分离得到5个异黄酮类化合物(55~59)。目前从水黄皮中分离得到的异黄酮类化合物见表 3,结构见图 3。
| 表 3 从水黄皮中分离得到的异黄酮类化合物 Table 3 Isoflavonoid compounds isolated from P. pinnata |
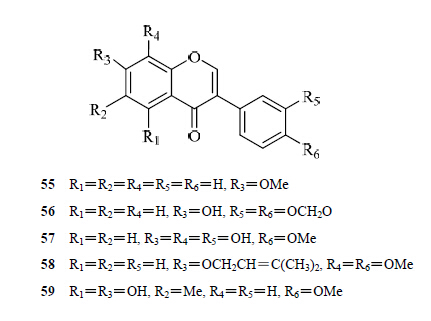 | 图 3 从水黄皮中分离得到的二氢黄酮类化合物的结构Fig. 3 Structures of isoflavonoid compounds isolated from P. pinnata |
迄今为止从水黄皮中已经分离得到28个査耳酮类化合物。其基本母核包括呋喃査耳酮(60~62)、呋喃二氢査耳酮(63),吡喃査耳酮(64~70)。水黄皮中分离得到的査耳酮及二氢査耳酮化合物见表 4,结构见图 4。
| 表 4 从水黄皮中分离得到的査耳酮及二氢査耳酮类化合物 Table 4 Chalcone and dihydrochalcone compounds isolated from P. pinnata |
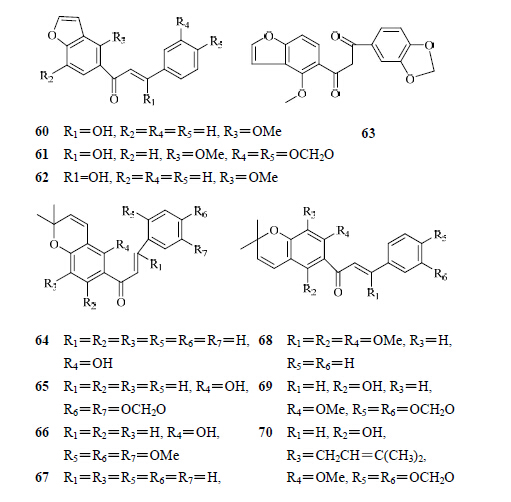 | 图 4 从水黄皮中分离得到的査耳酮及二氢査耳酮类化合物的结构Fig. 4 Structures of chalcone and dihydrochalcone compounds isolated from P. pinnata |
迄今为止从水黄皮中分离得到的三萜类化合物很少,2008年李莉娅等[6]从水黄皮根茎中分离得到白桦脂酸。
1.3 其他类2002年Simin等[25]从水黄皮种子中分离得到一个新的鱼藤酮类化合物。2006年黄欣碧等[17]从水黄皮叶中分离得到正三十二烷醇、蒲公英萜醇和正三十二碳酸。Satish等[26]从水黄皮根中分离得到紫杉醇、flurophenylalaline、长春碱、长春新碱、替尼泊苷、氟西汀和oetoposide衍生物。2006年李莉娅等[6]从水黄皮树干中分离得到过氧化麦角甾醇、11α-羟基-β-香树脂醇。2006年Yin等[27]从水黄皮的茎皮中分离得到两个烯化黄酮,同年李想等[28]分离得到一个生物碱类化合物。2012年Shang等[29]从水黄皮茎中分离得到2,3-didehydro-19a-hydroxy-14- epicochlioquinone B、6-O-desmethyldechlorog- riseofulvin、6′-hydroxygriseofulvin、dechlorogriseofulvin、griseofulvin、两个hydronaphthalenone衍生物、两个氧杂蒽酮和griseophenone C。
2 药理作用国内外学者对水黄皮的活性研究主要集中在抗菌、抗炎、镇痛、抗溃疡、抗惊厥、降血糖、抗疟原虫等方面,近十年的现代药理研究表明水黄皮在抗氧化、抗痢疾、治疗高血脂等方面有新的突出活性。
2.1 抗菌2010年Kesari等[30]研究表明水黄皮种子油提取物具有抗菌活性。实验选用单核细胞增生性李斯特菌等多种菌株;实验方法为稀释法和扩散法。结果表明水黄皮种子油的抗菌活性有浓度相关性,其最低抑菌浓度分别为40%(白色念球菌和黑曲霉菌)、45%(土曲霉)、50%(单核细胞增生性李斯特菌MTCC108和耶尔森氏鼠疫杆菌MTCC859)及60%(甲型副伤寒沙门氏菌)。
2.2 抗炎镇痛Srinivasan等[31]在小鼠热板法和小鼠扭体法的疼痛实验中给小鼠ig 100~1 000 mg/kg水黄皮叶的70%乙醇提取浓缩液(PLE),并采用Bliss法测定其半数致死量;实验证明PLE有显著的抗炎和镇痛作用。
2.3 抗溃疡Prabha等[32]用水黄皮种子的甲醇提取物对小鼠进行抗胃溃疡活性研究,研究表明水黄皮种子的甲醇提取物以剂量25 mg/kg ig 5 d对由低血压、阿司匹林等引起的胃溃疡具有明显的治疗作用。刘可云等[33]在研究水黄皮根醋酸乙酯萃取物(PRA)抗SD大鼠利血平型胃溃疡、阿司匹林型胃溃疡、幽门结扎型胃溃疡、乙酸型胃溃疡等实验性胃溃疡的作用中发现大鼠分别以70、210、630 mg/kg的剂量连续ig PRA 5 d后,其溃疡指数明显降低,中、高浓度剂量组其抑制率呈明显剂量相关性。
2012年,刘可云等[34]进一步研究了水黄皮根总黄酮(PRF)对胃溃疡大鼠醋酸型胃溃疡的作用,并探讨该药促进溃疡愈合的可能机制。采用醋酸注射至大鼠浆膜下形成胃溃疡模型,观察水黄皮根总黄酮以50、150、450 mg/kg不同剂量连续ig 14 d后模型组大鼠胃溃疡愈合情况,并用放免法检测血清表皮生长因子(EGF)的量,用免疫组化法检测胃黏膜组织EGF、转化生长因子-A(TGF-A)的表达。结果发现PRF能显著降低溃疡指数,提高血清中EGF的量,增强溃疡边缘胃黏膜EGF、TGF-A的表达(P<0. 05、0. 01)。
2.4 抗惊厥2009年Manigauha等[35]研究了水黄皮叶70%乙醇提取物的抗惊厥活性。ip戊二烯四唑80 mg/kg诱导大鼠痉挛,将发生惊厥的大鼠分成3组。组Ⅰ大鼠ig生理盐水1 mL/100 g,组Ⅱ大鼠ip苯妥英纳25 mg/kg,组Ⅲ大鼠ip水黄皮提取物250 mg/kg。实验结果显示水黄皮乙醇提取物能够明显减少惊厥的持续时间。实验说明水黄皮具有显著的抗惊厥活性。
2.5 降血糖Srinivasan等[36]研究表明水黄皮花的70%乙醇提取物对正常小鼠血糖无影响,对糖尿病小鼠有降血糖的作用。2010年Badole等[36]研究表明水黄皮树皮提取物cycloart-23-ene-3β, 25-diol(B2)具有治疗糖尿病的活性。用链脲霉素和尼克酰胺诱导小鼠产生糖尿病,给糖尿病小鼠喂食格列本脲和B2分别为10、1 mg/kg,用于长期疗效研究。在短期疗效研究中格列本脲和B2分别为10、3 mg/kg时都能降低血糖浓度;在长期疗效研究中,格列本脲和B2都能使小鼠体质量增加,同时使饮食量减少。在灌胃葡萄糖耐受性实验中,格列本脲和B2都能增加血液中和胰腺中胰岛素的量,经B2治疗,糖尿病小鼠超氧化物歧化酶和还原性谷胱甘肽的量增加,胰腺组织坏死的范围缩小。推断B2治疗糖尿病的机制可能是增加胰腺胰岛素的分泌和增加抗氧化活性。
2.6 抗疟原虫Simonsen等[38]用水黄皮乙醇提取物进行体外细胞活性研究,研究表明水黄皮乙醇提取取物具有明显的抗疟原虫活性。
2.7 抗氧化黄欣碧等[7]研究了水黄皮抗氧化活性,采用流动注射化学发光方法检测到水黄皮叶和茎均有抗氧化活性,叶的抗氧化活性强于茎,叶和茎提取物脂溶性部位抗氧化活性强于水溶性部位,脂溶性部位中叶醋酸乙酯萃取物和叶氯仿萃取物抗氧化活性最强。经定性实验可知这两萃取物主要含有黄酮类化合物和酚类成分,提示水黄皮的抗氧化活性主要成份可能是黄酮类化合物。
2.8 抗痢疾Brijesh等[39]用水黄皮叶的乙醇提取物进行抗微生物及抗肠毒性活性研究,研究表明水黄皮叶的乙醇提取物能够降低霍乱及细菌侵略上皮细胞,并能明显的抑制霍乱和肠侵袭性细菌引起的血液感染性腹泻痢疾等疾病。Brijesh等还研究了水黄皮叶煎煮粗提物的抗微生物活性、粗提物对肠毒素的产生和作用的影响及粗提物对致肠病型大肠杆菌和志贺氏菌对上皮细胞入侵的影响,结果发现该粗提物没有抗微生物活性,但是能够减少霍乱毒素的产生和减少细菌对上皮细胞的入侵。这些结果表明水黄皮的粗提物是一种对霍乱和致肠病型细菌引起的腹泻具有一定疗效的选择性止泻剂。
2.9 降血脂2008年Bhatia等[40]研究表明水黄皮果实的乙醇提取物具有降低血脂的活性。腹腔注射triton WR-1339 400 mg/kg诱导小鼠产生高血脂症后喂食水黄皮提取物250 mg/kg。氯仿提取物能够明显降低高血脂小鼠血液中的总胆固醇、三酰甘油和磷酸酯的量。体外实验中,氯仿提取物和正丁醇提取物在500 μg/L时能够明显抑制超氧阳离子和羟基自由基的产生,同时能够抑制Fe2+催化的小鼠肝脏微粒体中脂肪过氧化反应。用高果糖和高脂肪喂养的血脂异常的仓鼠,腹腔注射正丁醇提取物500 mg/kg,结果发现,仓鼠血浆中的三酰甘油、总胆固醇、高密度脂蛋白胆固醇葡萄糖和丙三醇的量显著降低。
3 结语水黄皮作为水黄皮属仅有的一种植物,其主要含有黄酮类、三萜类、生物碱类、氨基酸等成分,而其中以呋喃黄酮和吡喃黄酮为特征性成分,并且在水黄皮各个部位的分布具有一定的规律。现代药理学研究证明其多具有抗菌、抗炎、镇痛、抗溃疡、抗惊厥、抗疟原虫、降血糖作用外,其在抗氧化、抗痢疾、降血脂等方面也表现出良好的活性,但大多是在粗提物的水平上进行的,因此单体化合物的药理活性有待进一步的研究。随着医药技术的不断发展,水黄皮的新用途将进一步被挖掘,其作用机制也将进一步明确。水黄皮具有很好的应用前景,极具开发价值,值得深入研究。
| [1] | Arote S R, Yeole P G, et al. Pongamia pinnata L: a comprehensive review [J]. Int J Pharm Tech Res, 2010, 2(4): 2283-2290. |
| [2] | 江苏新医药学院中医药大词典 [M]. 上海: 上海科学技术出版社, 1977: 91-93. |
| [3] | Singh R K, Pandey B L. Anti-inflammatory activity of seed extracts of Ponamia pinnata in rat [J]. Indian J Physiol Pharmacol, 1996, 40(4): 355-358. |
| [4] | 黄欣碧, 龙盛京. 半红树植物水黄皮的化学成分和药理作用研究进展 [J]. 中草药, 2004, 35(9): 1073-1076. |
| [5] | Ghufran Ahmad, Prem P. Yadav, Rakesh Maurya. Furanoflavonoid glycosides from Pongamia pinnata fruits [J]. Phytochemistry, 2004, 65(7): 921-924. |
| [6] | 李莉娅, 李 想, 石 翠, 等. 半红树植物水黄皮的化学成分研究 [J]. 中国海洋药物, 2008, 27(1): 18-24. |
| [7] | 黄欣碧. 水黄皮化学成分及抗氧化活性研究 [D]. 南宁: 广西医科大学, 2005. |
| [8] | Yadav P P, Ahmad G, Maurya R. Furanoflavonoids from Pongamia pinnata fruits [J]. Phytochemistry, 2004, 65(4): 439-443. |
| [9] | Ranga Rao R, Tiwari A K, Prabhakar Reddy P, et al. New furanoflavanoids, intestinal α-glucosidase inhibitory and free-radical (DPPH) scavenging, activity from anti-hyper- glycemic root extract of Derris indica (Lam.) [J]. Bioorg Med Chem, 2009, 17(14): 5170-5175. |
| [10] | Yin H, Zhang S, Wu J. Prenylated flavonoids from Pongamia pinnata [J]. Z Naturforsch, 2005, 60b: 356-358. |
| [11] | 尹 浩, 张 偲, 吴 军. 水黄皮中黄酮类化合物的研究 [J]. 中药材, 2004, 27(7): 493-495. |
| [12] | Li L YY, Li X, Shi C, et al. Pongamone A - E, five flavonoids from the stems of a mangrove plant, Pongamia pinnata [J]. Phytochemistry, 2006, 67(13): 1347-1352. |
| [13] | Yin H, Zhang S, Wu J, et al. Dihydropyranoflavones from Pongamia pinnata [J]. J Braz Chem Soc, 2006, 17(7): 1432-1435. |
| [14] | Carcache-Blanco E J, Kang Y H, Park E J, et al. Constituents of the stem bark of Pongamia pinnata with the potential to induce quinone reductase [J]. J Nat Prod, 2003, 66(9): 1197-1202. |
| [15] | 赵映淑. 水黄皮质量标准及其提取物安全性评价研究 [D]. 重庆: 重庆医科大学, 2010. |
| [16] | Pathak V P, Saini T R, Khanna R. Isopongachromene, a chromenoflavone from Pongamia glabra seeds [J]. Phytochemistry, 1983, 22(1): 308-309. |
| [17] | 黄欣碧, 龙盛京. 水黄皮化学成分的研究 [J]. 中草药, 2006, 37(10): 1467-1469. |
| [18] | Minakawa T, Toume K, Ahmed F, et al. Constituents of Pongamia pinnata isolated in a screening for activity to overcome tumor necrosis factor-related apoptosis- inducing ligand-resistance [J]. Chem Pharm Bull, 2010, 58(11): 1549-1551. |
| [19] | Vismaya, Eipeson W S, Manjunatha J R, et al. Extraction and recovery of karanjin: a value addition to karanja (Pongamia pinnata) seed oil [J]. Ind Crops Products, 2010, 32(2): 118-122. |
| [20] | Yoon J S, Sung S H, Park J H, et al. Flavonoids from Spatholobus suberectus [J]. Arch Pharm Res, 2004, 27(6): 589-592. |
| [21] | Puebla P, Oshima-Franco Y, Franco L M, et al. Chemical constituents of the bark of Dipteryx alata vogel, an active species against bothrops jararacussu venom [J]. Molecules, 2010, 15: 8193-8204. |
| [22] | Shankar T, Muthusubramanian S, Gandhidasan R. Newer constituents of Derris indica stem [J]. Nat Prod Communic, 2008, 3(8): 1329-1331. |
| [23] | Fontenele J B, Leal L K A M, Ferreira M A D, et al. Antiplatelet effect of lonchocarpin and derricin isolated from Lonchocarpus sericeus [J]. Pharm Biol, 2005, 43(8): 726-731. |
| [24] | Lee Y R, Wang X, Xia L. An efficient and rapid synthetic route biologically intererting pyranochalcone natural products [J]. Molecules, 2007, 12(7): 1420-1429. |
| [25] | Simin K, Ali Z, Khaliq-Uz-Zaman S M, et al. Structure and biological activity of a new rotenoid from Pongamia pinnata [J]. Nat Prod Lett, 2002, 16(5): 351-357. |
| [26] | Satish Kumar B N. Phytochemistry and pharmacological studies of Pongamia pinnata (Linn.) Pierre [J] Inter J Pharm Sci Rev Res, 2011, 9(2): 12-19. |
| [27] | Yin H, Zhang S, Wu J, et al. Pongaflavanol: a prenylated flavonoid from Pongamia pinnata with a modified ring A [J]. Molecules, 2006, 11(10): 786-791. |
| [28] | 李 想, 孙光芝, 邓志威, 等. 红树植物水黄皮Pongamia pinnata中一个生物碱类化合物的研究 [EB/OL]. 北京: 中国科技论文在线 [2006-03-06]. http://www.paper.edu.cn/releasepaper/content/200603-84. |
| [29] | Shang Z, Li X M, Li C S, et al. Diverse secondary metabolites produced by marine‐derived fungus Nigrospora sp. MA75 on various culture media [J]. Chem Biodivers, 2012, 9(7): 1338-1348. |
| [30] | Kesari V, Das A, Rangan L. Physico-chemical characterization and antimicrobial activity from seed oil of Pongamia pinnata, a potential biofuel crop [J]. Biomass Bioenerg, 2010, 34(1): 108-115. |
| [31] | Srinivasan K, Muruganandan S, Lal J, et al. Anti- nociceptive and antipyreticactivities of Pongamia ponnata leaves [J]. Phytother Res, 2003, 17(3): 259-264. |
| [32] | Prabha T, Dorababu M, Goel S, et al. Effect of methanolic extract of Pongamia pinnata Linn seed on gastro- duodenal ulceration and mucosal offensive and defensive factors in rats [J]. Indian J Exp Biol, 2009, 47(8): 649-659. |
| [33] | 刘可云, 朱 毅, 董 志, 等. 水黄皮根乙酸乙酯萃取物抗实验性胃溃疡的作用 [J]. 中药材, 2007, 30(5): 576-580. |
| [34] | 刘可云, 朱 毅, 黄贤珍. 水黄皮根总黄酮对大鼠乙酸型胃溃疡胃黏膜EGF及TGF-α表达的影响 [J]. 中国应用生理学杂志, 2012, 28(5):435-438. |
| [35] | Manigauha A, Patel S, Monga J. Evaluation of anticonvulsant activity of Pongamia pinnata Linn in experimental animals [J]. Int J Pharm Tech Res, 2009, 1(4): 1119-1121. |
| [36] | Srinivasan K, Muruganandan S, Lal J, et al. Anti- nociceptive and antipyretic activities of Pongamia pinnata leaves [J]. Phytother Res, 2003, 17(3): 259-264. |
| [37] | Badole S L, Bodhankar S L. Antidiabetic activity of cycloart-23-ene-3β, 25-diol (B2) isolated from Pongamia pinnata (L. Pierre) in streptozotocin-nicotinamide induced diabetic mice [J]. Eur J Pharm, 2010, 632(1): 103-109. |
| [38] | Simonsen H T, Nordskjold J B, Smitt U W, et al. In vitro screening of Indian medicinal plants for antiplasmodial activity [J]. J Ethnopharmacol, 2001, 74(2): 195-204. |
| [39] | Brijesh S, Daswani P G, Tetali P, et al. Studies on Pongamia pinnata (L.) Pierre leaves: understanding the mechanism (s) of action in infectious diarrhea [J]. J Zhejiang Univ Sci B, 2006, 7(8): 665-674. |
| [40] | Bhatia G, Puri A, Maurya R, et al. Anti-dyslipidemic and antioxidant activities of different fractions of Pongamia pinnata (Lin.) fruits [J]. Med Chem Res, 2008, 17(2/7): 281-289. |
 2014, Vol.
2014, Vol. 


