通用名:palbociclib
别名:PD-0332991、PD0332991、PD 0332991、OTAVA-BB 1115529
化学名:6-乙酰基-8-环戊基-5-甲基-2-[[5-(哌嗪-1-基)吡啶-2-基]氨基]-8H-吡啶并[2,3-D]嘧啶-7-酮
CAS:571190-30-2
分子式:C24H29N7O2
相对分子质量:447.53
结构见图 1
原研公司:辉瑞制药有限公司(Pfizer)
药理分类:周期蛋白依赖性激酶4/6(CDK4/6)
适应症:乳腺癌
目前阶段:Ⅲ期临床
给药途径:口服
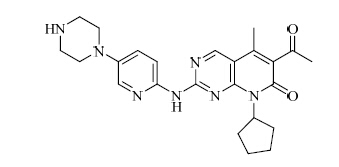 | 图 1 palbociclib的结构式Fig. 1 Structure of palbociclib |
乳腺癌是女性最常见的恶性肿瘤之一,发病率占全身各种恶性肿瘤的7%~10%,仅次于子宫癌,已成为威胁妇女健康的主要病因。它的发病常与遗传有关,并且40~60岁绝经期前后的妇女发病率较高。它是一种通常发生在乳房腺上皮组织,严重影响妇女身心健康甚至危及生命的的恶性肿瘤之一。
细胞周期蛋白依赖性激酶(CDK)共有13个成员,都属于丝氨酸/苏氨酸蛋白激酶家族,依赖与细胞周期蛋白(cyclin)的结合,促进细胞周期时相转变,启动DNA合成以及调控细胞转录等关键功能。在细胞周期不同时期中,不同cyclins的集聚与相应CDK结合并被激活,如cyclin D能与CDK2、CDK4、CDK5、CDK6结合,所形成的活性复合物在G0/G1期转换中起关键调控作用。cyclin E可与CDK2、CDK3结合,是Gl/S期DNA合成与M期有丝分裂的活化复合物[1]。因为CDKs在所有细胞包括健康和肿瘤细胞的增殖与死亡中所起的关键作用,广谱的CDK抑制剂,尤其是针对未经过基因筛选的患者很难展现较高的治疗窗口。剂量大了毒性太高,而小了又没有药效。所以选择地抑制部分CDK就变得格外重要。
在细胞增殖过程中,CDK4/6与细胞cyclin D形成的复合物能够磷酸化视网膜母细胞瘤蛋白(Rb)。肿瘤抑制蛋白Rb一旦发生磷酸化,可释放其在未被磷酸化的状态下紧密结合的转录因子E2F,E2F的激活进一步转录推动细胞周期通过R点并由生长期(G1期)向DNA复制期(S1期)转变,进入了细胞增殖的周期[2, 3]。CDK4/6抑制剂不同于既往作用于信号传导上游分子的靶向抗肿瘤药物从源头位置调控细胞周期,而是将细胞增殖阻滞于G1期,从而达到抑制肿瘤增殖的目的。在雌激素受体阳性(ER+)乳腺癌中,CDK4/6的过度活跃非常频繁,而CDK4/6是ER信号的关键下游靶标。在ER+乳腺癌中,雌激素信号传导导致了ER-cyclin D1-CDK4/6途径的活性增加,驱 动细胞自G1期向S期进程进而引起细胞增殖,最终引起细胞增殖失控,经过表观遗传和分子事件的级联放大,最终出现细胞无序增殖,致癌[4, 5, 6]。因此,抑制CDK4/6可以实现从信号通路的下游抑制细胞增殖。
乳腺癌细胞周期G1/S节点常常发生失调,palbocicib是一种口服的CDK4/6选择性抑制剂,通过阻止细胞周期从G1期进展到S期来防止DNA的合成[7, 8, 9],能够选择性抑制CDK4/6,恢复细胞周期控制,阻断肿瘤细胞增殖[10]。FDA于2013年4月授予palbociclib治疗晚期或转移性ER+/人表皮生长因子受体2阴性(HER2−)乳腺癌的突破性疗法认定。
3 合成路线[11]叔丁基氧羰基保护的哌嗪和5-溴-2-硝基吡啶在氮气保护下于65~70 ℃下反应30 h,后处理得到化合物1,化合物1在Pd/C催化下,氢气还原得到化合物2。5-溴-2,4-二氯嘧啶和环戊胺在25 ℃下反应2 h得到化合物3。化合物3和丁烯酸在THF和二异丙基乙基胺中混合搅拌,然后加入三邻甲苯基磷[(o-Tol)3P]和反二腈苯二氯化钯[PdCl2(PhCN)2],上述混合物在70 ℃下反应16 h,然后加入乙酸酐,继续搅拌1.5 h,经过后处理得到化合物4。化合物4和溴、醋酸钠在冰醋酸中混合,溶液加热到50 ℃并搅拌35 h,得到化合物5。化合物2和二(三甲基硅基)氨基锂在THF中混合搅拌10 min后加入化合物5,继续反应30 min后得到化合物6。化合物6和丁基乙烯基醚在正丁醇和二异丙基乙基胺中混合搅拌,然后加入[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物[Pd(dppf)2Cl2], 上述混合物在95 ℃下反应20 h,然后经过后处理得到化合物7。化合物7和甲醇混合加热至55~60 ℃,加入羟乙磺酸后处理得到目标化合物palbociclib的羟乙磺酸盐。palbociclib的合成路线见图 2。
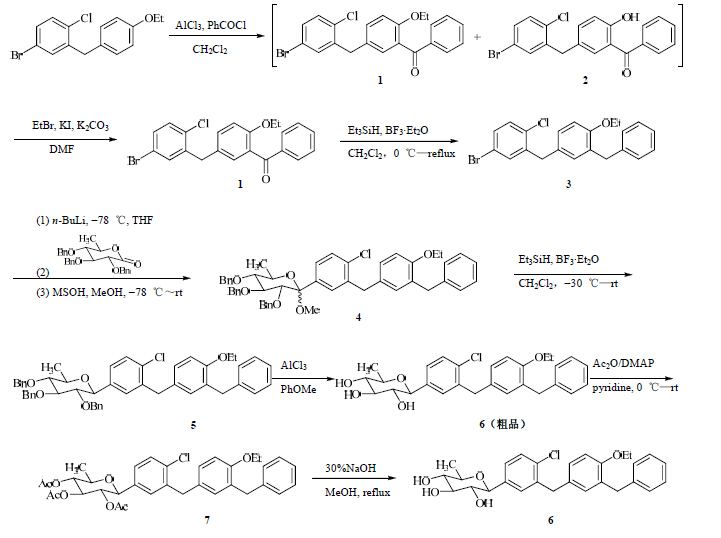 | 图 2 palbociclib的合成路线Fig. 2 Synthetic route of palbociclib |
palbociclib作用于乳腺癌细胞MDA-MB-435,能有效降低Rb在Ser 780、795位点的磷酸化,IC50分别为66、63 nmol/L。palbociclib通过抑制细胞进入S期,显著增强MDA-MB-453在G1期的百分比[7],有效抑制细胞生长,从而抑制DNA复制。Finn等[12]对47株人乳腺癌的研究发现,palbociclib对< /span>ER+细胞株的抑制作用更为明显,相反,对基底细胞样型ER+/HER2−最不敏感。palbociclib促进pRb和cyclin D1的基因表达,并且敏感细胞株都表现出cyclin D1水平上升,且降低CDKN2A(p16)基因表达。在绝经后妇女晚期或转移性的乳腺癌中,ER+细胞株占到了大约60%。palbociclib作用于条件性抗ER抑制的细胞系,增强对他莫昔芬的敏感性[12]。
NCT01756768研究对[14C]palbociclib在健康男性志愿者中的吸收、分布和排泄进行了研究。该项研究包含6名男性健康受试者,均给予125 mg单剂量的palbociclib。受试者在服药前12 h接受检查直到在排泄物中发现大于90%的放射物或连续几天从排泄物中检测不到1%的放射物。该研究用于调查参与palbociclib代谢的肝肾系统并寻找该化合物的主要代谢物[13]。
5 临床研究 5.1 I期临床一项非随机开放性的Ⅰ期临床试验NCT01701375用于确定palbociclib在复发难治性急性白血病和高风险的脊髓发育不良治疗中的可行性、耐受性以及毒性,并进一步用于确定palbociclib在恶性肿瘤细胞种群体内直接诱导细胞凋亡的能力[14]。
5.2 II期临床在一项palbociclib的单臂II期研究中显示,palbociclib单药治疗晚期乳腺癌具有良好的耐受性,对于不管之前是否接受过激素或化疗的乳腺癌患者,palbociclib均有一定的缓解率并能延长疾病稳定时间[15]。而在2012年的另一项随机II期研究中,比较了治疗组(palbociclib+来曲唑)和对照组(来曲唑)在绝经后ER+/HER2−晚期乳腺癌患者的效果,治疗组得到了显著更长的无进展生存期(26.1个月对7.5个月,P<0.001),并且耐受性良好[16]。
PALOMA-1研究将患者随机分为对照组和治疗组。对照组服用来曲唑2.5 mg,1次/d,连续服药治疗;治疗组在对照组基础上服用palbociclib 125 mg,1次/d,连续服用3周,停药1周,每4周重复,主要研究终点为无进展生存期。该研究分为两部分:第一部分纳入66例ER+/HER2−晚期乳腺癌患者;第二部分基于生物标记物CCND1扩增和(或)p16缺失选择性纳入另外99例ER+/HER2−晚期乳腺癌患者。研究结果表明,palbociclib联合来曲唑较来曲唑单药治疗显著延长ER+ /HER2−晚期乳腺癌患者的中位无进展生存期(20.2个月对10.2个月,P<0.001)[17]。PALOMA-1研究同样对研究次要终点总生存时间进行了统计分析。现有的研究数据显示,治疗组患者的中位总生存时间优于对照组(37.5个月对33.3个月),虽然目前看来两组间的总生存时间没有显著性差异,但考虑到本次无进展生存期最终分析时发生的中位总生存时间事件数相对较少、数据尚未成熟,因此Finn教授指出未来还会继续随访并更新总生存时间分析结果。早在2012年发布的PALOMA-1中期分析结果就已经显示出这一生存获益,本次的最终分析结果证明了这一获益的延续性和一致性。这项Ⅱ期临床试验纳入的研究对象为没有接受过针对复发转移性疾病进行治疗的ER+/HER2−晚期乳腺癌患者。PALOMA-1研究结果为ER+/HER2−乳腺癌 的治疗提供了新思路和新手段,必将推动靶向CDK4/6抑制剂类药物的研发进程。该药物在2013年4月就已经凭借其令人惊喜的中期分析结果获得了美国食品与药物管理局“重大突破”药物认定。
根据这些II期研究的数据,一项关于palbociclib联合来曲唑用于ER+/HER2−晚期乳腺癌女性的Ⅲ期随机多中心双盲研究正在进行中。
5.3 Ⅲ期临床辉瑞在乳腺癌患者中正进行这款药物的Ⅲ期临床试验,以及治疗其他类型癌症的早期试验。我国palbociclib Ⅲ期试验由中国医学科学院肿瘤医院的徐冰河教授牵头,2014年7月在北京召开启动大会。目前国内有20多家医疗单位参与palbociclib Ⅲ期试验,国外医疗机构也有将近10家。
在患者招募方面,Ⅲ期的患者有3个基本限定:第一,绝经后女性晚期乳腺癌;第二,ER+/HER2−患者;第三,复发转移后没有接受其他内分泌药物治疗。
6 安全性在安全性方面,联合使用palbociclib和来曲唑通常耐受性良好。联合治疗组的最常见不良事件为中性粒细胞减少、白细胞减少、疲劳和贫血。3/4级中性粒细胞减少达到54%,这与CDK4/6抑制剂的作用机制密切相关,有效地阻滞肿瘤细胞从G1期进展到S期的同时,对增殖活跃的中性粒细胞也有显著的影响。但是研究中的中性粒细胞减少均为自限性的,研究中没有中性粒细胞减少性发热的报告,并且没有感染并发症。研究中观察到的中性粒细胞减少没有累积作用并且易于临床管理。从临床经验来看,只要引起医生的足够重视,这一不良事件是能够较好控制和管理的。
7 结语细胞周期失控是癌症的一个标志性特征,CDK4/6在许多癌症中均过度活跃,导致细胞增殖失控。CDK4/6是细胞周期的关键调节因子,能够触发细胞周期从生长期(G1期)向DNA复制期(S1期)转变。在ER+乳腺癌中,CDK4/6的过度活跃非常频繁,而CDK4/6是ER信号的关键下游靶标。临床前数据表明,CDK4/6和ER信号双重抑制具有协同作用,并能够抑制G1期ER+乳腺癌细胞的生长。palbociclib是一种实验性、口服、靶向性CDK4/6抑制剂,能够选择性抑制CDK4/6,恢复细胞周期控制,阻断肿瘤细胞增殖。从Ⅱ期临床实验结果来看,CDK4/6抑制剂palbociclib的临床疗效具有非常明显的优势,因此,如能在Ⅲ期临床中得到预期的结果,必将给大批晚期乳腺癌患者带来更多的生存获益。
| [1] | 马 珂. CDK4/6抑制剂抗肿瘤作用研究进展 [J]. 国外医药: 抗生素分册, 2013, 34(5): 197-202. |
| [2] | Toogood P L, Harvey P J, Repine J T, et al. Discovery of a potent and selective inhibitor of cCyclin-dependent kinase 4/6 [J]. J Med Chem, 2005, 48(7): 2388-2406. |
| [3] | VanderWel S N, Harvey P J, McNamara D J, et al. Pyrido[2,3-d]pyrimidin-7-ones as specific inhibitors of cyclin-dependent kinase 4 [J]. J Med Chem, 2005, 48(7): 2371-2387. |
| [4] | Malumbres M, Pevarello P, Barbacid M, et al. CDK inhibitors in cancer therapy: what is next? [J]. Trends Pharmacol Sci, 2008, 29(1): 16-21. |
| [5] | Miller T W, Balko J M, Fox E M, et al. ERα-dependent E2F transcription can mediate resistance to estrogen deprivation in human breast cancer [J]. Cancer Discov, 2011, 1(4): 338-351. |
| [6] | Lange C A, Yee D. Killing the second messenger: targeting loss of cell cycle control in endocrine-resistant breast cancer [J]. Endocr Relat Cancer, 2011, 18(4): C19-C24. |
| [7] | Fry D W, Harvey P J, Keller P R, et al. Specific inhibition of cyclin-dependent kinase 4/6 PD 0332991 and associated antitumor activity in human tumor xenografts [J]. Mol Cancer Ther, 2004, 3(11): 1427-1438. |
| [8] | Toogood P L, Harvey P J, Repine J T, et al. Discovery of a Potent and Selective Inhibitor of Cyclin-Dependent Kinase 4/6 [J]. J Med Chem, 2005, 48(7): 2388-2406. |
| [9] | Sharpless N E, Strum J C, Bisi J E, et al. Hematopoietic protection against chemotherapeutic compounds using selective cyclin-dependent kinase 4/6 inhibitors [P]. WO: 2010039997, 2009-10-01. |
| [10] | Rocca A, Farolfi A, Bravaccini S, et al. Palbociclib (PD 0332991) : targeting the cell cycle machinery in breast cancer [J]. Expert Opin Pharmacother, 2014, 15(3): 407-420. |
| [11] | Erdman D T, Flamme C M, Nelson J D. Preparation of 2-(pyridin-2-ylamino)-pyrido[2,3-d]pyrimidin-7-ones [P]. WO: 2008032157, 2007-08-27. |
| [12] | Finn R S, Dering J, Conklin D, et al. PD 0332991, a selective cyclin D kinase 4/6 inhibitor, preferentially inhibits proliferation of luminal estrogen receptor-positive human breast cancer cell lines in vitro [J]. Breast Cancer Res, 2009, 11(5): R77. |
| [13] | ClinicalTrials.gov. A single-radiolabeled dose mass balance study to investigate the absorption, metabolism, and excretion of [14C] palbociclib (PD-0332991) in healthy male volunteers [OL]. [2014-08-25]. http:// www. clinicaltrials.gov/ct2/show/NCT01756768?term=palbociclib&rank=21. |
| [14] | ClinicalTrials.gov. A phase 1 trial of TST of PD 0332991 followed by cytarabine and mitoxantrone for adults with relapsed and refractory acute leukemias and high-risk myelodysplasia [OL]. [2014-08-25]. http://www.clinical trials. gov/ct2/show/NCT01701375?term=palbociclib&rank=29. |
| [15] | DeMichele A. A phase II trial of an oral CDK 4/6 inhibitor, PD0332991, in advanced breast cancer [C]. Chicago: 2013 ASCO Annual Meeting, 2013. |
| [16] | Vaughn D J, Gallagher M, Lal P, et al. Interim results of phase II trial of the cyclin-dependent kinase 4/6 inhibitor PD-0332991 in refractory retinoblastoma protein positive germ cell tumors [C]. Chicago: 2012 ASCO Annual Meeting, 2012. |
| [17] | Richard S. Finn M D. A randomized, multicenter, double-blind phase II study of palbociclib (PD-0332991), an oral CDK 4/6 inhibitor, plus letrozole versus placebo plus letrozole for the treatment of postmenopausal women with ER(+), HER2(-) breast cancer who have not received any prior systemic anticancer treatment for advanced disease [C]. Chicago: 2013 ASCO Annual Meeting, 2013. |
 2014, Vol.
2014, Vol. 


