从石杉科蕨类植物蛇足石杉里提取的石杉碱甲作为一种可逆性乙酰胆碱酯酶(AchE)抑制剂,已被证实对老年痴呆具有较好的治疗效果,而且被公认是最有前途的天然抗老年痴呆症药物之一[1, 2]。但由于野生蛇足石杉资源有限,生长缓慢,且石杉碱甲成分量少,其应用受到了很大限制。植物离体培养作为一种新兴的实用生物技术,近几年在离体培养药用植物产药效成分取得了可喜的成果[3],例如离体培养红豆杉产抗癌药物紫杉醇[4],离体培养夏日香薄荷产迷迭香酸[5],杜仲细胞悬浮培养产黄酮[6]。植物离体培养为避免整株植物的采伐、可控和可重复性地生产有价值的次生代谢物提供了一种很好的选择[7];可以节省大量用于栽培植株的土地,以便土地资源得到高效利用;离体培养周期短,可以减少各种环境因素对产物的影响;可以通过控制环境条件提高代谢物产量,并为研究产物的生产动力学及代谢途径提供条件[8]。
近年来,分离蛇足石杉的内生真菌,发酵培养生产石杉碱甲或分离纯化石杉碱甲的研究比较多[9, 10],但由于内生真菌离开宿主后石杉碱甲累积不稳定,菌种代谢特性退化严重。包日双等[11]报道,诱导蛇足石杉孢子体培养得到原叶体,并对原叶体增殖培养得到蛇足石杉孢子体取得了一定的成功。但有关提高蛇足石杉离体培养物生产石杉碱甲的最适条件鲜见报道,本实验在之前研究基础上[12],系统开展了提高蛇足石杉离体叶状体生产石杉碱甲条件优化研究,并对叶状体生长及代谢石杉碱甲的动力学模型进行了探究,它将为深入探究叶状体代谢石杉碱甲的生物合成途径及大规模培养蛇足石杉叶状体生产石杉碱甲提供一定的技术基础。
1 材料与方法 1.1 材料 1.1.1 植物材料由本实验室离体培养的有累积石杉碱甲能力的蛇足石杉叶状体[12]。该叶状体的外植体取自庐山多年生野生蛇足石杉植株,该蛇足石杉植株由中国科学院庐山植物园詹远怀研究员鉴定并提供。
1.1.2 主要试剂和仪器石杉碱甲对照品购自中国食品药品检定研究院(批号100243-201202),KQ3200DE型数控超声波清洗仪;岛津LC-20AT高效液相色谱仪。
1.2 方法 1.2.1 叶状体离体增殖优化条件设计取本实验室已经成功诱导的叶状体进行增殖培养条件优化。叶状体增殖培养主要在用1/2 MS基本培养基的基础上用正交试验方法对ZT(0、1.0、2.0 mg/L)、IAA(0、0.5、1.0 mg/L)、NAA(0、0.5、1.0 mg/L)进行筛选;基础培养基MS、1/2 MS(1/2的大量元素浓度)、1/4 MS(1/4的大量元素浓度);红光、蓝光、白光;不同光照时间(12、15 h/d)对叶状体的影响。每瓶接种约0.5 g,各处理重复4次,培养基pH值为5.8~6.2;培养温度(22±2)℃,光照强度30 μmol/(m2∙s)。
1.2.2 叶状体离体培养增殖量的测定采用通过测定相对增殖率进行对比,可以消除因接种量的差别而产生的影响。

叶状体收获后称定质量,55 ℃下烘干至恒定质量,研成粉末,精确称取干粉1.0 g于离心管中,加入10 mL 2%酒石酸溶液密封,55 ℃水浴锅浸泡24 h,100 MHz下超声30 min,离心收集上清液,重复3次。上清液pH调至5~6,氯仿萃取5次,将氯仿液收集自然风干,色谱级甲醇洗脱,定容于0.5 mL,0.45μm滤头滤过,用作高效液相色谱(HPLC)检测。
1.2.4 石杉碱甲的检测岛津LC-20AT高效液相色谱仪进行检测,色谱柱:依利特C18(200 mm×4.6 mm,5μm);流动相:甲醇-0.08 mol/L醋酸铵(pH 6.12)(3∶7);体积流量0.8 mL/min;检测波长308 nm;柱温25 ℃;进样量20 μL。
1.2.5 数据处理与统计分析数据采用SPSS软件进行数据统计,邓肯氏新复极差法分析;Origin 8.0软件作图进行曲线拟合。
2 结果与分析 2.1 外源激素对蛇足石杉离体培养叶状体增殖的影响在已经建立的无菌离体叶状体基础上,进一步探索叶状体增殖培养中外源激素的作用,本实验设计了L9(34) 正交试验。正交试验数据统计及分析见表 1。
| 表 1 L9(34) 正交试验设计表 Table 1 Orthogonal design L9(34) for optimization of biomass |
方差分析结果显示激素ZT、IAA、NAA对蛇足石杉离体叶状体培养增殖没有促进作用,显示为抑制其增殖。说明蛇足石杉离体培养叶状体增殖不需要添加外源激素ZT、IAA、NAA,叶状体可能有合成内源激素的能力。
2.2 培养基离子量对蛇足石杉离体培养叶状体增殖的影响大量元素是植物生长必须的营养元素,对细胞的生长代谢具有至关重要的作用,不同植物生长对离子的需求不一样。本研究通过在MS、1/2MS、1/4 MS培养基上培养的数据进行处理,结果见图 1。
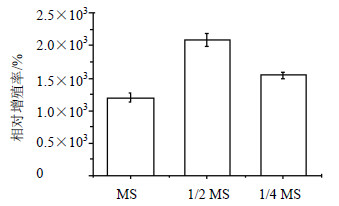 | 图 1 培养基大量元素浓度对蛇足石杉叶状体生长的影响Fig.1 Effects of concentration for major elements in medium on growth of thallus of H. serrata |
分析结果显示培养基中大量元素离子的浓度对叶状体增殖有极显著差异(P<0.01)。
1/2 MS基本培养基对叶状体相对增殖率最好,平均为2 086.5%。而MS基本培养基对叶状体相对增殖率最低,说明离体状态下蛇足石杉叶状体的生长对矿物养分的离子量需求较低,这为大规模培养的生产成本降低亦奠定了良好的基础。由于几种培养基生长的叶状体提取物在HPLC检测下,结果只有1/4 MS中生长的叶状体检测到目标产物,石杉碱甲质量分数为1.18 μg/g。故此选择1/4 MS为蛇足石杉叶状体离体培养的基本培养基。
2.3 不同光质对蛇足石杉离体培养叶状体增殖的影响在以白光为光源,不同光照强度及白光与蓝白光组合对比实验基础上,探讨不同光质对蛇足石杉离体培养叶状体增殖与累积有效成分石杉碱甲的影响,研究分别设计相同光照强度[30 μmol/(m2∙s)]红光、蓝光、白光作光源培养叶状体,培养70 d收获。分别测定它们的相对增殖率及统计石杉碱甲量,结果见图 2。由图 2可知,白光培养的蛇足石杉叶状体生长量及石杉碱甲累积量均最高,相对增殖率达到1 547.65%,石杉碱甲质量分数达到1.94 μg/g。
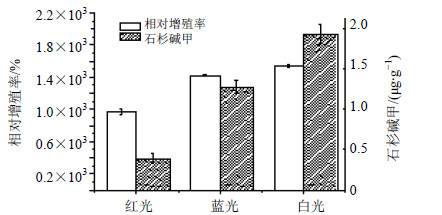 | 图 2 不同光质对蛇足石杉离体培养叶状体增殖和石杉碱甲量的影响Fig.2 Effect of different light qualities on thalus growth rate and Hup A concent in in vitro cultures of H. serrata |
前期试验表明,光照培养比黑暗培养蛇足石杉叶状体增殖与累积石杉碱甲有利。为了解光照时间长短对蛇足石杉叶状体的培养效应,本实验在最佳培养条件下,分别接种3个株系(紫外诱导筛选出的不同株系,编号为UZ20、UZ8、UZ5)形态均匀,生长旺盛的叶状体,以12、15 h/d时间为光照处理,培养70 d收获叶状体,测定相对增长率和石杉碱甲量,结果见图 3。由图 3可以看出,12 h/d光照时间的叶状体累积石杉碱甲的能力优于15 h/d光照的叶状体。12 h/d的光照对蛇足石杉叶状体累积石杉碱甲更适宜。
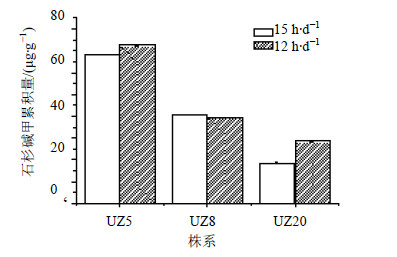 | 图 3 不同光照时间对叶状体累积石杉碱甲量的影响Fig.3 Effect of different light time on thallusaccumulation Hup A content in in vitro cultures of H. serrata |
在上述优化条件下,接种生长45 d形态均匀的旺盛叶状体。由于转代对培养物有一定的影响,接种的培养物在20 d内处于滞生阶段,20 d后可以看到叶状体有增长趋势,因此本实验从20 d后,每隔10 d对叶状体进行一次收获,直至60 d,以后每隔5 d收获一次直到90 d为止。检测了叶状体的增殖及石杉碱甲的量随培养时间的变化动态,结果见图 4。蛇足石杉离体培养叶状体提取物及石杉碱甲对照品的HPLC图谱见图 5,石杉碱甲对照品出峰时间为11.243 min,样品提取物的目标物出峰时间为11.303 min,可见,目标物出峰时间在高效液相允许的误差范围内,叶状体提取物中出峰指纹多说明次生代谢生物碱类物质种类多,成分比较复杂,诱导转化为目标产物的空间很大。由图 4可知,培养30d的叶状体开始快速增殖,60 d后增长量开始减慢,75 d后叶状体基本不增长,叶状体生长进入稳定期,叶状体的相对增殖量达到127.3 g/L。60 d后石杉碱甲的累积量开始迅速增加,85 d达到最大量7.57 μg/g,以后呈快速下降趋势,可能代谢物发生降解或转化。
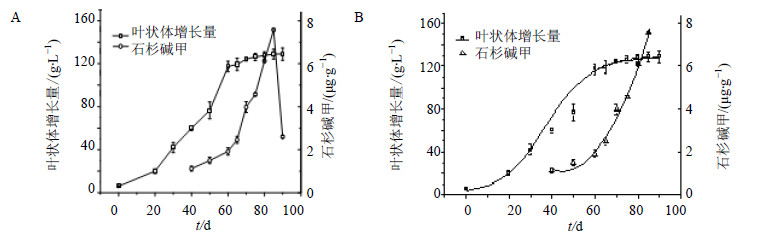 |
A-蛇足石杉叶状体离体培养生长与石杉碱甲累积曲线 B-Logistic理论方程与实验值拟合曲线 A-time-course of H. serrata thallus in vitro cultureB-theory of Logistic equation and experimental value of curve fitting 图 4 动力学模型计算与实验值的比较Fig.4 Comparison on actual value and predicted ones by kinetic models |
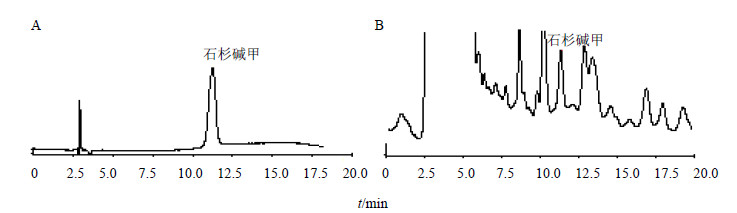 | 图 5 石杉碱甲对照品 (A) 及蛇足石杉离体叶状体培养物提取物 (B) 的HPLCFig.5 HPLC of Huperzine A reference subslances (A) and thallus extractof in vitro culture (B) of H. serrata |
由图 4-A可以看出叶状体增殖及石杉碱甲量的动态变化,即蛇足石杉叶状体的生长曲线呈“S”型,石杉碱甲的动态累积曲线呈倒“V”形。采用Logistic方程来反映蛇足石杉叶状体生长模型,参考文献的处理方法[6],求出最大生长速率(μmax)为0.071 d−1,其相关性系数为0.98。表明该模型可以较好的模拟该生长条件下的蛇足石杉离体培养叶状体的生长规律。根据图 4可以看出蛇足石杉叶状体累积石杉碱甲的能力与叶状体增殖不成正相关的关系,表明产物石杉碱甲的合成累积与叶状体的增殖属非生长偶联型[13]。将相关参数带入动力学模型中,绘制曲线得图 4-B,比较图 4-B中点与曲线可以看出,理论值与实验值相当吻合,令人满意,说明离体叶状体生长特征符合Logistic理论动力学模型,它为大规模培养离体叶状体生产石杉碱甲的工艺设计奠定了理论基础。
3 讨论提高植物离体培养中次生代谢物产量的方法很多[14],目前本研究主要从化学因素(激素及培养基种类)和物理因素(光质、光照时间)对叶状体进行培养优选。植物生长激素对蕨类植物组织培养过程起着重要的作用,如水蕨营养叶作为外植体进行愈伤组织诱导的最佳激素组合为NAA 0.5mg/L+6-BA 1.0 mg/L[15]。但本研究结果显示外源激素(ZT、IAA、NAA)抑制叶状体的增殖,本实验室已对叶状体增殖过程的内源激素水平变化进行了研究,将在另篇文章中报道。蕨类植物离体培养的培养基有多种,如MS、1/2MS、KP,有研究发现以高盐度培养基会抑制某些蕨类植物的分化与增殖[16],本研究显示1/4MS培养基对蛇足石杉叶状体增殖合成石杉碱甲最有利。光是植物生长不可缺少的因素,有研究报道蓝光最有利于白桦愈伤组织中三萜的积累[17],蓝光促进花色素的形成,白光促进葡萄中白藜芦醇的量[18],对不同光质、光照时间培养叶状体的结果显示:12 h/d的白光光照培养下的叶状体增殖及石杉碱甲量最高。
在培养条件优化的基础上,探索了叶状体增殖及合成石杉碱甲的动力学模型,其生长曲线符合Logistic“S”曲线模型,石杉碱甲的合成与叶状体的增殖呈非偶联型,研究的结论可以在分批培养蛇足石杉叶状体生产石杉碱甲的应用中,提高对数期(30~60d)叶状体的增殖率,在稳定期(80 d左右)结束培养,以获得最高的石杉碱甲产量,超过85 d石杉碱甲的量就有所降低。这和Ishiuchi等[19]提出离体培养中石杉碱甲降低是转化为其他物质现象相符合,但本研究的培养物85 d石杉碱甲迅速下降,属目标产物降解还是转化,其机制有待进一步探明。蛇足石杉离体细胞的培养动力学模型,通过模型的回归拟合,获得了反映蛇足石杉细胞培养的动力学参数,这对于培养过程优化、代谢产物的调控和扩大培养起着重要作用。
| [1] | 王月娥, 岳冬贤, 唐希灿. 石杉碱甲的抗胆碱酯酶作用 [J]. 中国药理学报, 1986, 7(2): 110-113. |
| [2] | 王 斌, 何熙昌, 白东鲁. 老年痴呆药物石杉碱甲类似物研究V. 光学活性 (-)-1-甲基石杉碱甲的全合成 [J]. 药学学报, 1999, 34(6): 434-438. |
| [3] | 张延红, 何春雨, 刘晓博, 等. 甘肃道地黄芪种苗的离体快繁研究 [J]. 中草药, 2008, 39(11): 1729-1732. |
| [4] | 张长河, 刘华文, 梅兴国. 条件培养液对红豆杉细胞Paclitaxel生产的促进作用 [J]. 生命科学研究, 2001, 5(1): 63-67. |
| [5] | Tepe B, Sokmen A. Production and optimization of rosmarinic acid by Satureja hortensis L. callus cultures [J]. Nat Prod Res, 2007, 21: 1133-1144. |
| [6] | 颜日明, 张志斌, 邱晓芳, 等. 杜仲细胞悬浮培养产黄酮及动力学研究 [J]. 中国生物工程杂志, 2008, 28(10): 60-65. |
| [7] | Yang S W, Ubillas R, McAlpine J, et al. Three new phenolic compounds from a manipulated plant cell culture, Mirabilis jalapa [J]. J Nat Prod, 2001, 64: 313-317. |
| [8] | 谷荣辉, 洪利亚, 龙春林. 植物细胞培养生产次生代谢物的途径 [J]. 植物生理学报, 2013, 49(9): 869-881. |
| [9] | Ying Y M, Shan W G, Zhan Z J. Biotransformation of Huperzine A by a fungal endophyte of Huperzia serrata furnished sesquiterpenoid-alkaloid hybrids [J]. J Nat Prod, 2014, 77: 2054-2059. |
| [10] | Su J Q, Yang M H. Huperzine A production by Paecilomyces tenuis YS-13, an endophytic fungus isolated from Huperzia serrata [J]. Nat Prod Res, 2014, 27: 1-7. |
| [11] | 包日双, 尹培培, 郭 斌, 等. 蛇足石杉原叶体的培养及孢子体的诱导 [J]. 植物生理学报, 2012, 48(4): 393-396. |
| [12] | 吉枝单, 涂艺声, 丁明华, 等. 蛇足石杉离体培养产生有效成分的研究 [J]. 天然产物研究与开发, 2014, 26(05): 645-649. |
| [13] | 曹竹安, 陈 坚. 生物反应工程原理 [M]. 北京: 清华大学出版社, 2011. |
| [14] | 马玉芳, 许继宏. 提高植物细胞培养中次生代谢产物产量的方法 [J]. 云南大学学报: 自然科学版, 2003, 25(S1): 142-145. |
| [15] | 庄哲煌, 蔡汉权, 李粪玲, 等. 植物激素对水蕨愈伤组织诱导与增殖的影响 [J]. 湖北农业科学, 2010, 30(2): 170-173. |
| [16] | 尹铁龙, 孙平平. 蕨类植物组织培养研究进展 [J]. 园艺与种苗, 2012(3): 59-61. |
| [17] | 范桂枝, 詹亚东, 王 博, 等. 光质、光周期对白桦愈伤组织生长和三萜质量分数的影响 [J]. 东北林业大学学报, 2009, 37(1): 1-3. |
| [18] | 张 真, 李 胜, 李 唯, 等. 不同光质对葡萄愈伤组织增殖和白藜芦醇含量的影响 [J]. 植物生理学通讯, 2008, 44(1): 106-108. |
| [19] | Ishiuchi K, Park J J, Long R M, et al. Production of huperzine A and other Lycopodiun alkaloids in Huperzia species grown under controlled conditions and in vitro [J]. Phytochemistry, 2013, 91: 208-219. |
 2016, Vol. 47
2016, Vol. 47


