舒血宁注射液是由银杏叶提取物制备而成的中药注射剂,其活性成分主要包含银杏叶总黄酮及银杏叶总内酯等,具有扩张血管、改善微循环的作用,临床上用于治疗缺血性心脑血管疾病、冠心病、心绞痛、脑栓塞、脑血管痉挛等[1]。关于舒血宁注射液定量测定方面的研究已有多篇文献报道[2-3],但由于中药对照品昂贵、不易得等原因限制了定量测定方法的推广使用。本实验以舒血宁注射液中的山柰素和白果内酯为内参物,分别建立该2种成分与槲皮素、异鼠李素和银杏内酯A、B、C间的相对校正因子(fk/s),实现用一测多评法测定舒血宁注射液中7种成分的量。
一测多评法是指利用中药有效成分内在函数关系和比例关系,只测定1个成分实现多个成分的同步测定[4-5],该方法是通过建立成分之间的fk/s来对多个成分进行定量检测的,因而fk/s在不同仪器、不同实验条件下的重现性如何是一测多评法定量是否准确的关键。一测多评法的另一个关键因素是成分色谱峰的定位方法,常用的色谱峰定位方法有相对保留时间定位法和保留时间差定位法。
本实验考察了所建立的fk/s在不同仪器及不同实验条件下的重现性,并采用相对保留时间定位法对各待测成分的色谱峰进行了定位;最后,将用一测多评法测定的5批舒血宁注射液的结果与用HPLC外标法测定的结果进行了t检验,对将一测多评法应用于舒血宁注射液多组分的定量测定进行了较为全面的考察。
1 仪器与试药Aglient1100高效液相色谱系统,UV检测器,蒸发光散射检测器,色谱柱分别为Dikxna C18(250 mm×4.6 mm,5 μm)、Hypersil ODS C18(150 mm×4.6 mm,5 μm)、Luna C18(150 mm×4.6 mm,5 μm)、Agilent C18(250 mm×4.6 mm,5 μm);AB135S型电子天平,梅特勒-托利多有限公司。
舒血宁注射液,通化谷红制药有限公司,规格:5 mL/支,批号141107/1、150307/2、150511/1、150615/2、150809/2;对照品槲皮素(批号100081- 200406,质量分数98%)、山柰素(批号110861- 200606,质量分数98%)、异鼠李素(批号110860- 200608,质量分数98%)、白果内酯(批号110865- 200303,质量分数98%)、银杏内酯A、B、C(批号110862-200305、110863-200204、110864-200203,质量分数分别为99%、99 %、99%)均购自中国食品药品检定研究院;甲醇、四氢呋喃为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法与结果 2.1 溶液的配制 2.1.1 混合对照品溶液银杏总黄酮:精密称取槲皮素、山柰素及异鼠李素对照品适量,加甲醇制成含槲皮素、山柰素及异鼠李素0.03、0.03、0.02 mg/mL的黄酮苷元对照品混合溶液,即得。银杏总内酯:精密称取银杏内酯A、B、C及白果内酯对照品适量,加丙酮制成分别含银杏内酯A、B、C和白果内酯0.10、0.05、0.10、0.25 mg/mL的对照品混合溶液,即得。
2.1.2 供试品溶液银杏总黄酮:取舒血宁注射液10支(5 mL/支),混匀,精取2 mL,加甲醇-12 moL/L盐酸(7∶1)混合溶液8 mL,68 ℃水浴加热3 h,冷却,滤过,取续滤液,即得。银杏总内酯:取舒血宁注射液10支(5 mL/支),混匀,精取25 mL,加稀盐酸调节pH值至2.0,然后用醋酸乙酯提取4次(80、40、40、40 mL),合并醋酸乙酯液,用5%的醋酸钠溶液80 mL洗涤,分离出醋酸乙酯层,醋酸钠溶液再用醋酸乙酯40 mL洗涤,合并醋酸乙酯液及洗涤液,用水洗涤2次,每次80 mL,分离醋酸乙酯液,蒸干,残渣加丙酮适量溶解,并转移至2 mL量瓶中,加丙酮稀释至刻度,摇匀,用0.45 μm滤膜滤过,取续滤液,即得。
2.2 色谱条件[2-3] 2.2.1 银杏总黄酮色谱柱为Dikxna C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.4%磷酸溶液(47∶53),体积流量0.8 mL/min,UV检测器,检测波长360 nm,柱温45 ℃;
2.2.2 银杏总内酯色谱柱为Dikxna C18柱(250 mm×4.6 mm,5 μm);流动相为四氢呋喃-甲醇-水(10∶20∶75),体积流量1.0 mL/min,蒸发光散射检测器,以空气为载气,体积流量3 L/min,漂移管温度105 ℃,柱温40 ℃。
在上述色谱条件下,取混合对照品溶液及供试品溶液各进样10 μL,典型色谱图见图 1。
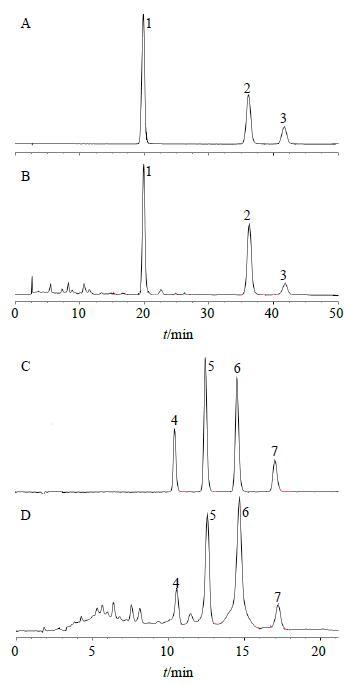
|
图 1 总黄酮混合对照品 (A) 及供试品 (B) 和总内酯混合对照品 (C) 及供试品 (D) HPLC图 Fig.1 HPLCof total flavonoids mixed reference substances (A),total flavonoids sample (B),total lactones mixed reference substances (C),and total lactones sample (D) |
2.3 一测多评方法学考察 2.3.1 线性关系的考察
精密量取“2.1.1”项下银杏总黄酮及银杏总内酯混合对照品溶液2、5、8、10、15、20 μL,按“2.2”项下的色谱条件进样分析,以对照品进样量为横坐标(X),相应的峰面积值为纵坐标(Y),进行线性回归,得到各组分的回归方程及线性范围分别为槲皮素Y=8.521×103 X+2.12,r=0.999 7,线性范围60~600 μg;山柰素Y=5.355×103 X-5.18,r=0.999 6,线性范围60~600 μg;异鼠李素Y=3.158×103 X+3.74,r=0.999 5,线性范围40~400 μg;银杏内酯A Y=5.715×104 X+14.27,r=0.999 7,线性范围200~2 000 μg;银杏内酯B Y=1.195×104 X-26.83,r=0.999 4,线性范围100~1 000 μg;银杏内酯C Y=3.183×104 X+16.83,r=0.999 6,线性范围200~2 000 μg;白果内酯Y=1.063×104 X+13.57,r=0.999 8,线性范围500~5 000 μg。
2.3.2 精密度试验分别精取“2.1.1”项下的银杏总黄酮和银杏总内酯对照品溶液,按照“2.2”项下色谱条件,连续进样6次,每次10 μL,记录各成分的色谱峰面积,结果槲皮素、山柰素、异鼠李素和银杏内酯A、B、C及白果内酯峰面积的RSD分别为0.4%、0.7%、0.6% 和0.3%、0.2%、0.5%、0.6%,表明本方法精密度良好。
2.3.3 稳定性试验精密吸取同一舒血宁注射液供试品溶液10 μL,室温放置,按照“2.2”项下色谱条件,分别于0、2、4、6、8、24 h进样10 μL,记录色谱峰面积,考察其溶液稳定性,结果槲皮素、山柰素、异鼠李素和银杏内酯A、B、C及白果内酯峰面积的RSD分别为1.1%、1.5%、1.3%和0.9%、0.7%、1.2%、1.5%,表明舒血宁注射液供试品溶液在24 h内基本稳定。
2.3.4 重复性试验精密吸取同一舒血宁注射液供试品溶液6份,每份10 μL,按照“2.2”项下色谱条件进样分析,结果槲皮素、山柰素、异鼠李素和银杏内酯A、B、C及白果内酯峰面积的RSD分别为0.2%、0.4%、0.3%和0.3%、0.5%、0.2%、0.3%,表明该方法重复性较好。
2.3.5 加样回收率试验取已测定的舒血宁注射液样品(批号141107/1)9份,3份1组,分别加入约相当于样品中质量分数50%、100%、150%的槲皮素、山柰素及异鼠李素对照品,按照“2.1.2”项银杏总黄酮项下处理方法制备供试品溶液,精取该供试品溶液10 μL,按上述色谱条件进样分析,计算加样回收率,结果槲皮素、山柰素及异鼠李素的平均加样回收率分别为99.9%、99.8%、100.1%,RSD分别为0.2%、0.3%、0.8%;同样取已测定的舒血宁注射液样品(批号141107/1)9份,3份1组,分别加入约相当于样品中质量分数50%、100%、150%的银杏内酯A、B、C及白果内酯对照品,按照“2.1.2”项银杏总内酯项下处理方法制备供试品溶液,精取该供试品溶液10 μL,按上述色谱条件进样分析,计算加样回收率,结果银杏内酯A、B、C及白果内酯的平均加样回收率分别为99.5%、99.6%、99.9%、99.9%,RSD分别为0.8%、0.7%、0.7%、0.9%。
2.4 fk/s重现性的考察及各组分色谱峰的定位 2.4.1 fk/s的计算以山柰素和白果内酯为内参物,分别计算山柰素对槲皮素、异鼠李素和白果内酯对银杏内酯A、B、C的fk/s[6],结果见表 1、2。
|
|
表 1 槲皮素和异鼠李素与山柰素的fk/s Table 1 fk/sof quercetin and isorhamnetin to artemisinin |
|
|
表 2 银杏内酯A、B、C与白果内酯的fk/s Table 2 fk/sof ginkgolide A,B,and C to bilobalide |
fk/s=fk/fs=WkAs/(WsAk)
Ak为内参物峰面积,Wk为内参物质量浓度,As为其他组分峰面积,Ws为其他组分质量浓度
2.4.2 不同仪器及色谱柱对fk/s的影响本实验考察了不同仪器和不同色谱柱对fk/s的影响,结果表明不同仪器和不同色谱柱所得的fk/s差异性不大(RSD<0.5%),见表 3、4。
|
|
表 3 不同仪器及色谱柱fk/s耐用性考察 (银杏总黄酮) Table 3 fk/s determined by different instruments and columns (total flavonoids) |
|
|
表 4 不同仪器及色谱柱fk/s耐用性考察 (银杏总内酯) Table 4 fk/s determined by different instruments and columns (total lactones) |
2.4.3 不同柱温对fk/s的影响
实验在不同的实验室进行,采用岛津LC20A高效液相色谱系统、Dikxna C18色谱柱分别考察了不同柱温对fk/s的影响,结果显示柱温对fk/s的影响不显著(RSD<0.5%),见表 5、6。
|
|
表 5 不同柱温fk/s耐用性考察 (银杏总黄酮) Table 5 fk/s determined by different column temperatures (total flavonoids) |
|
|
表 6 不同柱温fk/s耐用性考察 (银杏总内酯) Table 6 fk/s determined by different column temperatures (total lactones) |
2.4.4 不同体积流量对fk/s的影响
实验在同一实验室进行,采用岛津LC20A高效液相色谱系统、Dikxna C18色谱柱分别考察了不同的体积流量对fk/s的影响(RSD<0.5%),结果见表 7、8。
|
|
表 7 不同体积流量fk/s耐用性考察 (银杏总黄酮) Table 7 fk/s determined by different flow rates (total flavonoids) |
|
|
表 8 不同体积流量fk/s耐用性考察 (银杏总内酯) Table 8 fk/s determined by different flow rates (total lactones) |
2.4.5 不同实验室间fk/s的考察
以山柰素和白果内酯为内参物,在2个不同的实验室间分别对槲皮素、异鼠李素和内酯A、B、C的fk/s进行复核计算,结果表明2个实验室间的差异不大(RSD<1.0%),结果见表 9、10。
|
|
表 9 不同实验室测得的fk/s (银杏总黄酮) Table 9 fk/s in different laboratories of components (total flavonoids) |
|
|
表 10 不同实验室测得的fk/s (银杏总内酯) Table 10 fk/s in different laboratories of components (total lactones) |
2.4.6 待测组分色谱峰的定位
由相关文献[6-10]可知,在色谱峰的定位方法选择上,相对保留时间定位法优于保留时间差定位法,相对保留时间定位法在一测多评中使用更为广泛。本实验分别考察了采用不同的色谱仪及色谱柱时,槲皮素、异鼠李素色谱峰与山柰素色谱峰的相对保留时间及银杏内酯A、B、C色谱峰与白果内酯色谱峰的相对保留时间,结果表明,不同色谱仪及色谱柱所测得的各成分相对保留时间无显著性差异(RSD<0.5%),见表 11、12。
|
|
表 11 不同色谱仪及色谱柱相对保留时间 (银杏总黄酮) Table 11 Relative retention time determined by different instruments and columns (total flavonoids) |
|
|
表 12 不同色谱仪及色谱柱相对保留时间 (银杏总内酯) Table 12 Relative retention time determined by different instruments and columns (total lactones) |
2.5 一测多评法与外标法测定结果的比较
本实验采用一测多评法和外标法对5批舒血宁注射液进行了定量检测,取舒血宁注射液5批(141107/1、150307/2、150511/1、150615/2、150809/2),照“2.1.2”项下方法处理,“2.2”项下色谱条件进样,分别采用外标法和一测多评法计算舒血宁注射液中各组分的量,并对测定结果进行t检验,结果表明2种方法测得成分量无显著性差异,见表 13。
|
|
表 13 不同批次样品的定量测定 (n = 5) Table 13 Content determination of different batches of samples (n = 5) |
3 讨论 3.1 一测多评法的色谱峰的定位
中药的化学成分非常复杂,在不同的色谱系统中会有不同的色谱峰,在同一色谱系统中,其色谱峰的数量、出峰时间及峰形等也受到色谱柱、仪器、溶剂、柱温等诸多因素的影响,因此,待测成分色谱峰的定位至关重要。
对于在一定的色谱条件下,色谱峰相对较少的中药,可根据《中药注射剂色谱指纹图谱研究的技术要求(暂行)》[11]推荐的相对保留时间对各组分的色谱峰进行定位。本实验采取该方法定位,相对保留时间在不同的色谱系统及色谱柱条件下重现性较好(RSD<0.5%)。
3.2 一测多评法内参物的选择实验选择山柰素和白果内酯作为内参物,因为该2种成分在舒血宁注射液中质量浓度较高,且性质稳定[12]。
3.3 fk/s的重现性理论上来讲,在特定的色谱条件下同一化合物的fk/s可以在不同的仪器上重现,在相同的色谱条件下,可以用化合物的fk/s对其进行定量分析,目前fk/s在气相色谱分析中的应用较为广泛,而在液相色谱分析,特别是中药分析检测中的应用还较少。本实验用fk/s对舒血宁注射液中的槲皮素、异鼠李素与银杏内酯A、B、C进行了定量检测,结果与外标法测定的结果无显著性差异。
本实验考察了不同仪器、色谱柱、柱温及体积流量对fk/s的影响,结果各fk/s在以上不同的条件下重复性良好,表明一测多评法用于分析舒血宁中各组分的通用性较好,可在不同的实验室条件下进行定量检测。
| [1] | 胡书佑. 舒血宁注射液的临床应用与安全用药[J]. 湖南中医药大学学报, 2012,32 (11) :78–81. |
| [2] | 欧琴, 张芦燕, 钱一鑫, 等. HPLC法测定舒血宁注射剂黄酮和内酯的含量[J]. 贵州大学学报: 自然科学版, 2010,27 (5) :34–37. |
| [3] | 王海涛, 冯志琼, 蔡海燕, 等. HPLC-ELSD法测定舒血宁注射液配伍溶液中内酯含量[J]. 机电信息, 2011,6 (6) :9–12. |
| [4] | 王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006,31 (23) :1925. |
| [5] | 石伟, 王振中, 倪付勇, 等. 一测多评法在六味地黄软胶囊质量评价中的应用[J]. 中草药, 2015,46 (19) :2880–2886. |
| [6] | 付滢舟, 冯有龙, 曹玲, 等. 一测多评法测定速效救心丸中冰片的含量[J]. 药物分析杂志, 2012,32 (5) :775–778. |
| [7] | 黄帅, 马淼, 黄倩倩, 等. 一测多评法同步测定柴胡药材中3种皂苷的含量[J]. 时珍国医国药, 2010,21 (4) :838–840. |
| [8] | 李玲, 赵顺, 罗疆南, 等. 一测多评法测定胃苏颗粒中4种成分的含量[J]. 药物分析杂志, 2015,35 (4) :751–757. |
| [9] | 靳瑞婷, 杨素德, 付娟, 等. 一测多评法测定芪白平肺颗粒中8种皂苷类成分[J]. 中草药, 2015,46 (24) :3682–3686. |
| [10] | 连赟芳, 陈丹, 蔡韦炜, 等. 一测多评法同时测定玳玳果黄酮滴丸中4个活性成分的含量[J]. 药物分析杂志, 2015,35 (6) :974–978. |
| [11] | 国家药品监督管理局. 关于印发《中药注射剂色谱指纹图谱研究的技术要求(暂行)》的通知[J]. 中成药, 2000,22 (10) :671. |
| [12] | 吕连媛, 张黎明, 王艳乔, 等. 银杏萜内酯A、B、C和白果内酯的热特征分析[J]. 天津科技大学学报, 2011,26 (5) :9–12. |
 2016, Vol. 47
2016, Vol. 47


