2001年12月葛兰素史克公司的磺达肝癸钠获得美国FDA正式批准,2002年在美国、英国、加拿大等多个国家上市,2008年获准中国进口,商品名为安卓。磺达肝癸钠是由化学合成得到的,具有确定结构的化合物,见图 1。由于它的结构复杂,合成路线长,成本高,所以普及和推广一直受到限制。其合成中的难点为多步涉及到α、β异构体的糖苷立体选择性反应[1, 2],甲苷单糖中间体的合成就是其中之一。
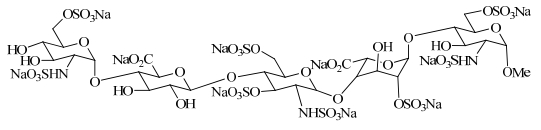 | 图 1 磺达肝癸钠的结构式 Fig.1 Structure of fondaparinux sodium |
通过查找文献[3, 4, 5, 6],发现目前此甲苷单糖片段的 合成方法比较一致,均使用了叠氮保护磺达肝癸钠中单糖氨基的合成策略。本课题组对文献中的方法进行了重复,并稍作优化,经甲苷反应、苄基化反应得到单糖片段,提高了反应的转化率,合成路线见图 2。但化合物2依旧为α、β异构体,路线中更是使用了比较危险的叠氮试剂,增加了放大生产的难度。
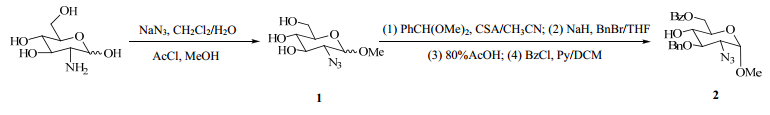 | 图 2 磺达肝癸钠甲苷单糖的合成路线一 Fig.2 No. 1 Synthesis route of methyl glucosamine of fondaparinux sodium |
考虑全保护五糖合成磺达肝癸钠需经过碱性水解、磺化反应、氢化还原、二次磺化反应[7, 8, 9],而叠氮基团和苄氧酰胺都能用氢化还原方法去保护,生成氨基,所以本课题组选用苄氧酰基代替比较危险叠氮基团保护氨基进行路线改良,设计了一条选择性高,且相对廉价和安全的合成路线,方便其实现工业化生产。见图 3。
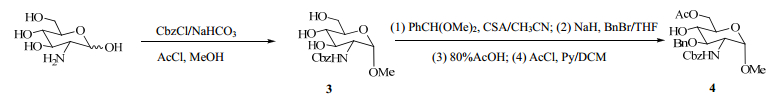 | 图 3 磺达肝癸钠甲苷单糖的合成路线二 Fig.3 No. 2 Synthesis route of methyl glucosamine of fondaparinux sodium |
Waters e2695-2998系列高效液相色谱仪(美国Waters公司);Bruker Avance 400 MHz型核磁共振波谱仪(德国Bruker公司);岛津2010EV质谱仪(日本岛津公司)。D-氨基葡萄糖(质量分数≥95%),购自湖北楚盛威化工有限公司。其余所用试剂均为市售分析纯。
2 方法与结果 2.1 甲苷-2-苄氧基碳酰胺基-2-去氧-α-D-吡喃葡萄糖(3)的合成取纯水15 L、D-氨基葡萄糖(1 kg,4.64 mol)和碳酸氢钠(788 g,9.28 mmol)加入20 L反应釜中,0 ℃下滴加苯甲氧羰酰氯(700 mL,5.10 mol),室温搅拌18 h,抽滤,干燥后固体待用。无水甲醇10.4 L加入20 L反应釜,氮气保护下,0 ℃滴加乙酰氯1.04 L。将待用固体加入反应釜,65 ℃加热搅拌6.5 h,淬灭反应(pH值约为9),并旋干。加入8 L水,搅拌30 min。抽滤,干燥得到白色固体3(960 g),产率80.1%。ESI-MS m/z:349.9 [M+Na]+;1H-NMR(400 MHz,DMSO-d6)δ:7.28~7.35(m,5H,Ph),7.11(d,1H,J=8.0 Hz,NH),5.00(s,2H,Cbz-CH2),4.98(d,1H,J=6.4 Hz,OH-4),4.76(d,1H,J=6.4 Hz,OH-3),4.55(d,1H,J=2.8 Hz,H-1),4.52(t,1H,OH-6),3.67~3.78(m,1H,H-3),3.40~3.46(m,3H,H-2、CH2-6),3.22(s,3H,OCH3),3.10~3.16(m,2H,H-4、5)。从化学位移4.55处的偶合常数2.8 Hz可以看出化合物3为α构型产物。
色谱条件:Venusil MP C18色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇(A)-氨水(B),梯度洗脱:0~5 min,30%A;5~25 min,80%A,保持5 min;30~35 min,30%A,保持10 min。柱温为30 ℃;检测波长为220 nm;体积流量为1.0 mL/min。在上述色谱条件下,化合物3的保留时间为16.281 min,质量分数为93.5 %,见图 4。
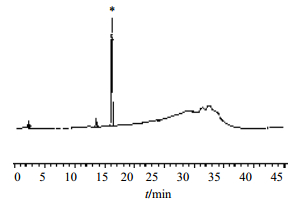 | *-化合物 3 *-compound 3图 4 化合物3的色谱图 Fig.4 HPLC of compound 3 |
将化合物3(960 g,2.95 mol)加入30 L反应釜中,再加入樟脑磺酸(68.5 g,295 mmol)、苯甲醛缩二甲醇(670 mL,4.42 mol)和乙腈12 L,55 ℃下搅拌7 h。加入石油醚12 L,室温搅拌30 min。抽滤,干燥后装入30 L反应釜中,加入四氢呋喃18 L,氮气保护,保持0 ℃搅拌,分3批加入氢化钠(118 g,2.92 mol)。再加入苄溴(365 mL,3.03 mol),40 ℃搅拌12 h。将反应液移入100 L釜中,缓慢加入35 L水,搅拌30 min。抽滤,干燥后加入20 L反应釜中,再加入二氯甲烷380 mL和80%醋酸水溶液5.7 L,55 ℃下搅拌6 h。除去醋酸,加入水5.20 L、二氯甲烷2.6 L,并用碳酸钾调pH值至9,搅拌1 h,大量析出。抽滤,干燥后加入20 L反应釜,再加入二氯甲烷15 L和三乙胺(200 mL,1.44 mol),滴加乙酰氯(90 mL,1.27 mol)后,0 ℃搅拌40 min,加入2 mol/L盐酸溶液1.9 L萃取,水层用二氯甲烷萃取(400 mL×2)。合并有机层,旋干。用醋酸乙酯-石油醚(2∶1)结晶得白色固体化合物4(343 g),收率51.5%。ESI-MS m/z:481.9 [M+Na]+;1H-NMR(400 MHz,CDCl3)δ:7.22~7.27(m,10H,2Ph),5.04(AB,2H,J=12.4 Hz,Bn-CH2),4.88(d,1H,J=9.6 Hz,NH),4.64(s,2H,Cbz-CH2),4.61~4.62(d,1H,J=3.6 Hz,H-1),4.42(dd,1H,J=4.0、12.0 Hz,H-2),4.16(d,1H,J=12.4 Hz,H-3),3.88~3.93(m,1H,H-4),3.62~3.65(m,1H,H-5),3.44~3.47(m,2H,H-6),3.28(s,3H,OCH3),2.68(s,1H,OH),2.04(s,3H,Ac)。
岛津Inertsil C8-3色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇(A)-水(B);梯度洗脱:0~5 min,20%A;5~20 min,80%A,保持5 min;25~30 min,20%A,保持5 min。柱温为30 ℃;检测波长220 nm;体积流量为1.0 mL/min。在上述色谱条件下,化合物4的保留时间为21.60 min,质量分数为98.6%,见图 5。
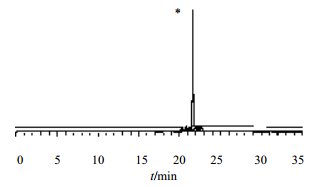 | *-化合物 4 *-compound 4图 5 化合物4的色谱图 Fig.5 HPLC of compound 4 |
本课题组对磺达肝癸钠关键中间体甲苷单糖片段的合成进行了优化研究。
3.1 化合物3的合成磺达肝癸钠甲苷单糖的合成路线一中的化合物1粗品为α、β异构体混合物,α异构体只占66%,见图 6。由于化合物1为油状物,需采用操作复杂的柱色谱提纯,收率仅约40%。采用本方法制备化合物1,提纯分离难度大,生产成本高,同时产出大量废液,环保压力大。
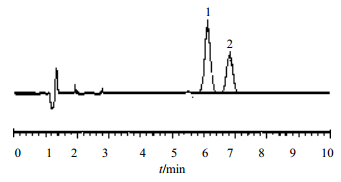 | 1-α 异构体 2-β 异构体 1-α isomer 2-β isomer图 6 化合物1的色谱图 Fig.6 HPLC of compound 1 |
磺达肝癸钠甲苷单糖的合成路线二中的化合物3作为方法优化后化合物1的替换物,由于Cbz-NH的邻位效应,甲苷反应产物为高纯度的α构型,不用进行异构体分离,且化合物3为固体,最终采用的处理方法为水打浆,使得分离提纯得到极大简化,收率约80%。此处理方法简单易用,成本低,污染少。
3.2 化合物4的合成磺达肝癸钠甲苷单糖的合成路线一中化合物1至化合物2的合成过程中需用到3次柱色谱提纯,这主要是因为过程中的所有中间体均为油状物,提纯不便,收率不足20%。
磺达肝癸钠甲苷单糖的合成路线二中化合物2的替代物化合物4,经过优化将BzCl替换为AcCl,使得过量酰氯容易被洗掉,方便后处理。由于所有中间体均为固体,其他反应原料均为油状物,可以用打浆法除去绝大部分过量的反应原料及副产物,极大地简化了提纯处理操作。最后产品经过结晶,质量分数达到了98.5%以上,收率为50%以上。
本文采用的新方法具有如下优点:(1)反应立体选择性高,获得了高纯度的α异构体,避免了难度较大的α、β异构体分离,反应总收率由7%升至41%,提高近6倍。(2)各步中间体均为固体,可用打浆法提纯,得到较高纯度的中间体,省去了费时费力的柱层析分离提纯,减少了废液量。(3)舍弃了叠氮高危试剂,提高了生产的安全性,方便放大生产。
优化后的工艺提高了收率,简化了操作,工艺稳定可靠,易重复,安全环保,提高了可执行性。此工艺已经过中试生产验证,完全可以为磺达肝癸钠的放大生产提供足量的单糖片段,方便磺达肝癸钠注射液投放市场。
| [1] | Sinay P, Jacquinet J C. Total synthesis of a heparin pentasaccharide fragment having high affinity for antithrombin III[J]. Carbohydr Res, 1984, 132:C5-C9. |
| [2] | 韩健, 干浩, 周喜泽, 等. 磺达肝癸钠二糖中间体的合成工艺研究[J]. 现代药物与临床, 2015, 30(6):605-609. |
| [3] | Polat T, Wong C H. Anomeric reactivity-based one-pot synthesis of heparin-like oligosaccharides[J]. J Am Chem Soc, 2007, 129(42):12795-12800. |
| [4] | Bock V D, Hiemstra H, Maarseveen J H. CuI-catalyzed alkyne-azide "click" cycloadditions from a mechanistic and synthetic perspective[J]. Eur J Org Chem, 2006(1):51-68. |
| [5] | Rostovtsev V V, Green L G, Fokin V V, et al. A stepwise huisgen cycloaddition process:copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes[J]. Angew Chem Int Ed, 2002, 41(14):2596-2599. |
| [6] | Zhou Y, Lin F, Chen J, et al. Toward synthesis of the regular sequence of heparin:synthesis of two tetrasaccharide precursors[J]. Carbohydr Res, 2006, 341(10):1619-1629. |
| [7] | Codée J D, Stubba B, Schiattarella M, et al. A modular strategy toward the synthesis of heparin-like oligosaccharides using monomeric building blocks in a sequential glycosylation strategy[J]. J Am Chem Soc, 2005, 127(11):3767-3773. |
| [8] | Crich D, Smith M. 1-Benzenesulfinyl piperidine/trifluoromethanesulfonic anhydride:a potent combination of shelf-stable reagents for the low-temperature conversion of thioglycosides to glycosyl triflates and for the formation of diverse glycosidic linkages[J]. J Am Chem Soc, 2001, 123(37):9015-9020. |
| [9] | Petitou M, Duchaussoy P, Lederman I, et al. Synthesis of heparin fragments:a methyl alpha-pentaoside with high affinity for antithrombin III[J]. Carbohydr Res, 1987, 167:67-75. |
| [10] | Richard J B H N, van den Berg, Daan Noort, et al. Synthesis of pseudo-disaccharide analogues of lipid A:haptens for the generation of antibodies with glycosidase activity towards lipid A[J]. J Carbohyd Chem, 2002, 21(3):167-188. |
 2016, Vol. 31
2016, Vol. 31


