2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西省分析科学研究院 核磁共振检测研究室, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Nuclear Magnetic Resonance Detection Laboratory, Shanxi Academy of Analytical Sciences, Taiyuan 030006, China
款冬花是菊科款冬属植物款冬Tussilago farfara L. 的干燥花蕾,性温,味辛、微苦,具有润肺下气、止咳化痰的功效,主治喘咳痰多、劳嗽咯血、急慢性气管炎等症,始载于《神农本草经》,列为中品,谓其“主咳逆上气,善喘,喉痹,诸惊痫、寒热邪气”[1]。国内外现已报道款冬花的化学成分类型主要包括黄酮、萜类、酚类、生物碱类和挥发油等[2]。
中药的炮制加工是保证临床安全用药、提高疗效的重要步骤,其中蜜炙是中药炮制的重要方法之一,款冬花通过蜜炙可以提高药物疗效,增强润肺止咳的作用[3]。目前已有研究对款冬花蜜炙前后化学成分进行了比较,韩超等[4]利用HPLC法比较了10批款冬花蜜炙前后的款冬酮质量分数的变化;李红军等[5]用UPLC-Q-TOF/MS法比较了款冬花蜜炙前后的化学成分变化,确定蔗糖、芦丁、绿原酸等成分为款冬花生品与蜜炙品的差异性成分。
植物代谢组学技术以组群指标分析为基础,借助高通量检测和数据处理手段,具有整体观的研究思路,特别适合中药这种多成分、复杂体系的分析[6, 7]。基于核磁共振的代谢组学分析具有备样简单、重复性好、分析时间短,能同时检测到各种极性化合物的优势,此方法已成功运用于黄芪[8]、厚朴[9]、人参[10]、地黄[11]、远志[12]、白芍和赤芍[13]、阿胶[14]、细辛[15]、驴皮[16]等中药材的分析中。本研究采用NMR代谢组学技术对款冬花生品与蜜炙品进行比较,以期从整体物质组角度阐明款冬花蜜炙的科学内涵。
1 仪器与材料RE-52A旋转蒸发仪,上海亚荣生化仪器厂;Bruker 600-MHz AVANCE III NMR Spectrometer,600.13 MHz扫场频率,德国布鲁克公司600 MHz核磁仪;KQ5200E超声清洗器,昆山市超声仪器有限公司; SC-3610低速离心机,安徽中科中佳科学仪器有限公司;TGL-16高速台式冷冻离心机,湘仪离心机仪器有限公司。甲醇(分析纯),氯仿(分析纯),娃哈哈纯净水,NMR试剂重水(Norell,Landisville,美国),氘代甲醇(99.8%)、氘代氯仿(99.8%),德国Merck公司;Buffer试剂:KH2PO4溶于D2O中,以1 mol/L氘代氢氧化钠溶液调节pH值至6.0,含0.01% 2,2,3,3-三甲基甲硅烷基氘代丙酸盐(TSP)。本研究所用的4批款冬花药材见表 1,样品均经山西大学秦雪梅教授鉴定为菊科款冬属植物款冬Tussilago farfara L. 的干燥花蕾,标本保存于山西大学中医药现代研究中心。
| 表 1 款冬花样品 Table 1 Samples of Farfarae Flos |
首先制取炼蜜,参照《中国药典》2010年版方法,取蜂蜜适量,炼制呈黄褐色有均匀气泡出现,手捻有黏性、能拉白丝即可。然后取药材样品各50 g,分别加入20 g(蜜的比例50%)炼蜜[3],拌匀闷润3 h至透,置炒锅内炙炒至深黄色,放冷即可。
2.1.2 核磁样品制备参照本课题组前期建立的方法[17],精密称取液氮研磨后的款冬花生品和蜜炙品粉末各200 mg,置于10 mL离心管中,分别加纯净水及甲醇各1.5 mL,氯仿3 mL,涡旋混匀1 min,超声提取25 min,室温下离心(3 500 r/min)25 min,提取液分为2层(上层为水溶性部分即甲醇水相,下层为氯仿相),用移液枪分别转移至25 mL圆底烧瓶中,减压浓缩蒸干。于测定前用NMR试剂溶解,其中甲醇水相层用氘代甲醇400 μL与Buffer试剂400 μL溶解,溶解液分别转移至1.5 mL离心管中,离心(13 000 r/min)10 min,移取上清液600 μL至5 mm核磁管中待测,而氯仿相部分用氘代氯仿600 μL溶解,直接转移到5 mm核磁管中待测。每份药材平行制备样品2份。
2.2 炼蜜的核磁共振分析取炼蜜40 mg,加入含0.05% TSP的重水溶液800 μL于1.5 mL的EP管中,离心(3 500 r/min)10 min,移取上清液600 μL至5 mm标准核磁管。样品于600 MHz NMR(25 ℃)核磁仪上测定,采用noesygppr1d脉冲序列,扫描次数为64,谱宽为12 345.7 Hz,脉冲时间为14 μs,采样时间2.654 s,延迟时间1.0 s,采样数据点为65 536,图谱分辨率0.188 Hz,采样间隔40.5 μs,内标为TSP。
2.3 样品的NMR测定及条件样品于600 MHz NMR(25 ℃)仪上测定:甲醇水相提取物核磁测定采用noesygppr1d序列压制水峰,用氘代甲醇进行锁场,内标为TSP,扫描次数为64,谱宽为12 345.7 Hz,脉冲时间为14 μs,采样时间2.654 s,延迟时间1.0 s,采样数据点为65 536。氯仿相提取物核磁测定采用zg30序列,用氘代氯仿锁场,内标为TMS。
2.4 数据分析核磁图谱采用MestReNova(version 8.0.1,Mestrelab Research,Santiago de Compostella,西班牙)进行处理。核磁图谱经过定标、相位、基线校准后,以δ 0.04积分段对化学位移区间进行分段积分。甲醇水相核磁图谱中对化学位移δ 0.91~10.0进行分段积分,去掉δ 4.70~5.10(残余水峰)和δ 3.30~3.38(残余甲醇峰)积分段以消除水峰和甲醇峰的影响,氯仿相核磁图谱中对化学位移δ 0.53~8.5进行分段积分,去掉δ 7.20~7.30(残余氯仿峰)的积分值。将积分数据导入SIMCA-P 13.0(瑞典Umetrics,Umea)软件中进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal PLS-DA,OPLS-DA),找出差异代谢物,并在SPSS 16.0中进行单变量分析。
2.5 炼蜜和蜜炙款冬花的化学成分分析首先对炼蜜进行初步化学分析,以明确炼蜜对款冬花成分的影响,通过化学位移、耦合常数、峰形等信息,从炼蜜中指认出8个化合物(图 1),包括氨基酸、有机酸、糖类等。其次对蜜炙款冬花成分进行化学归属,本课题组前期通过文献及数据库HMDB(http://www.hmdb.ca/)、BMRB(http://bmrb. wisc.edu/)中标准物质对照的方式,已从款冬花生品和蜜炙品图谱中指认出40个代谢产物(图 2)[17]。款冬花的化学组成复杂,所得的核磁图谱可以提供大量的化学指纹信息,但是对款冬花生品和蜜炙品的核磁图谱(图 3)进行直观比较显示两者的差异不大,因此需进一步采用多元统计分析方法对两者进行深入比较。
 | 图 1 炼蜜的1H-NMR图谱指认Fig.1 1H-NMR spectrum of refined honey |
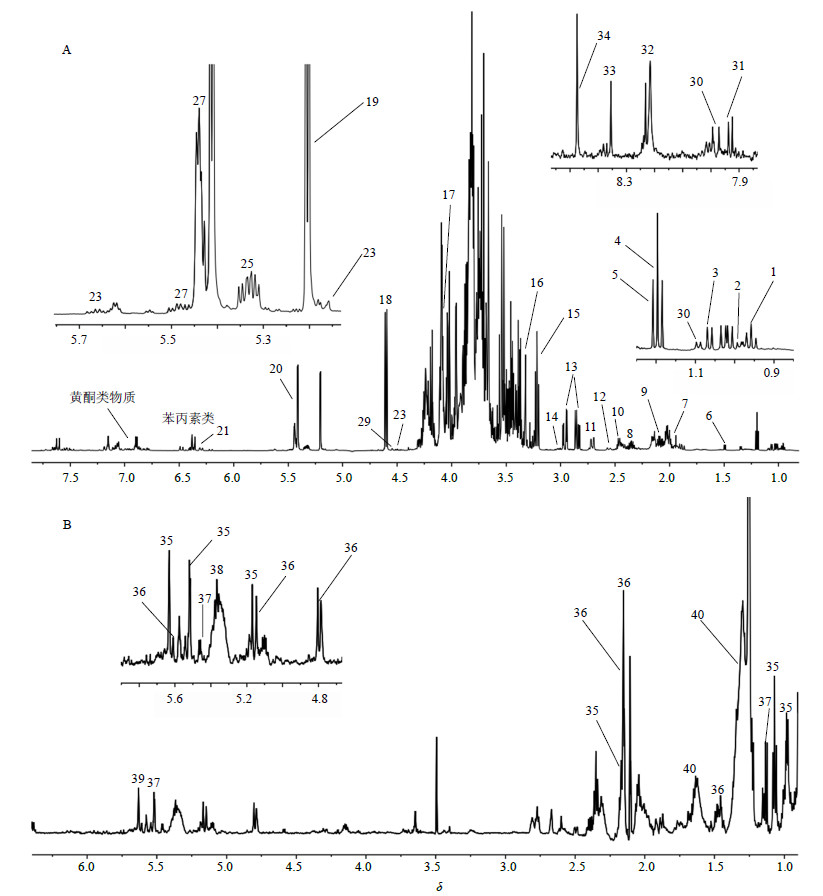 |
1-异亮氨酸 2-亮氨酸 3-缬氨酸 4-1-O-乙基-β-D-葡萄糖苷 5-苏氨酸 6-丙氨酸 7-乙酸 8-脯氨酸 9-谷氨酸 10-琥珀酸 11-苹果酸 12-柠檬酸 13-天冬氨酸 14-胆胺 15-胆碱 16-磷脂酰胆碱 17-肌酐 18-β-葡萄糖 19-α-葡萄糖 20-蔗糖 21-富马酸 22-反丁烯二酸 23-4,5-二咖啡酰基奎尼酸 24-咖啡酸 25-绿原酸 26-芥子酸 27-3,5-二咖啡酰基奎尼酸 28-3,4-二咖啡酰基奎尼酸 29-芦丁 30-山柰酚 31-p-羟基甲苯酸 32-腺嘌呤 33-腺嘌呤核苷 34-甲酸 35-甲基丁酸-3,14-Z-去氢款冬素酯(EMDNT) 36-款冬酮 37-款冬巴耳二醇 38-β-谷甾醇 39-谷甾酮 40-脂肪酸 1-isoleucine 2-leucine 3-valine 4-1-O-ethyl-β-D-glucoside 5-threonine 6-alanine 7-acetic acid 8-proline 9-glutamine 10-succinic acid 11-malic acid 12-citric acid 13-aspartate 14-ethanolamine 15-choline 16-phosphatidylcholine 17-creatine 18-β-glucose 19-α-glucose 20-sucrose 21-maleic acid 22-fumaric acid 23-4,5-O-dicaffeoylquinic acid 24-caffeic acid 25-chlorogenic acid 26-sinapic acid 27-3,5-O-dicaffeoylquinic acid 28-3,4-O-dicaffeoylquinic acid 29-rutin 30-kaempferol 31-p-hydroxybenzoic acid 32-adenine 33-adenosine 34-formic acid 35-EMDNT [7-(3'-ethylcrotonoyloxy)-1a-(2'-methyl-butyryloxy)-3,14-dehydro-Z-notonipetranone] 36-tussilagone 37-bauer-7-ene- 3β,16α-diol 38-β-sitosterol 39-sitosterone 40-fatty acids 图 2 蜜炙样品水相 (A) 和有机相 (B) 的1H-NMR图谱 Fig.2 1H-NMR spectra of aqueous extracts (A) and organic extracts (B) of HFF |
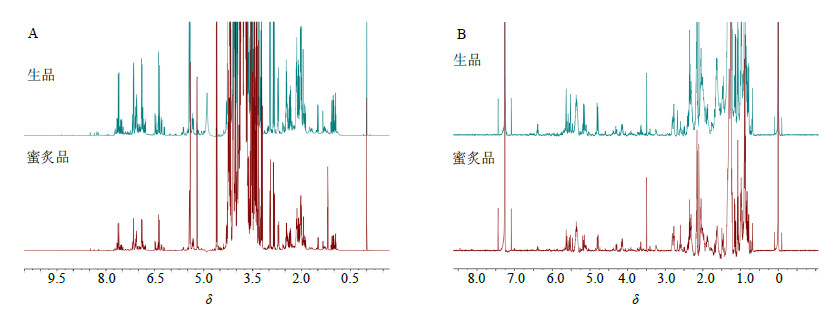 | 图 3 生品和蜜炙品的水相 (A) 和有机相 (B) 1H-NMR图谱 Fig.3 1H-NMR spectra of aqueous extracts (A) and organic extracts (B) of RFF and HFF |
无监督的模式识别方法——PCA分析可以反映数据的原始状态,直观地显示不同样品之间的整体差异,故先对4批款冬花蜜炙品和生品进行PCA分析,从图 4可以看出,4批不同款冬花样品之间存在一定化学差异,而且蜜炙后款冬花化学组成会发生一定改变:对于水相提取物,款冬花蜜炙前后分离趋势明显,即蜜炙对极性成分引起的化学差异大于样品之间的差异;对于有机相提取物,蜜炙前后分离趋势不明显,即蜜炙对低极性成分所引起的化学差异与样品之间的差异相当。说明款冬花的蜜炙过程对其极性成分的影响较大。
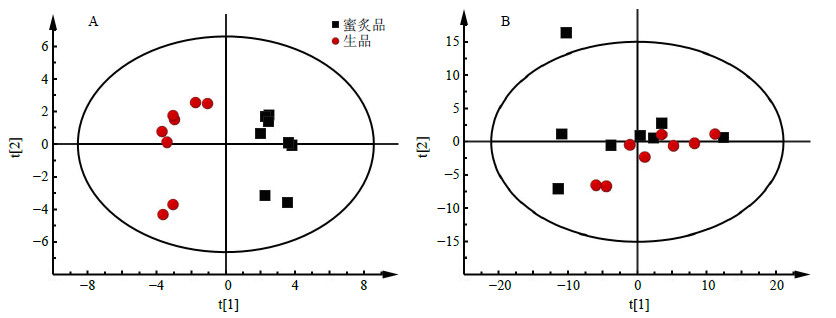 | 图 4 水相 (A) 和有机相 (B) 的PCA图Fig.4 PCA score plots of aqueous methanol extracts (A) and chloroform extracts (B) |
有监督的模式识别方法可以扩大组间差异,但需要用外部模型验证方法排列实验来证明模型的有效性。在排列实验中,R2、Q2值分别表示在随机化y变量模型下对数据的解释程度和对模型的预测能力。如果回归线的斜率越大,与纵轴的截距越小,提示有越多的数据用来解释模型,因而模型的预测能力也比较好。由图 5-A、B可见,下方回归线纵轴相交并处于零点以下,左端任何一次随机排列产生的R2、Q2均小于右端,且2条回归线斜率较大,最右端的2个值差距较小,说明原始模型的预测能力大于任何一次随机排列y变量的预测能力,即模型有效。表明款冬花生品与蜜炙品之间低极性成分的差异虽然较小,但仍然有统计学意义。
 | 图 5 水相 (A) 和有机相 (B) 的模型验证图Fig.5 Validation of models of aqueous phase (A) and organic phase (B) |
有监督模式的OPLS-DA分析可以去除与Y矩阵(在本研究中Y为分组信息)无关的X矩阵的变化,从而使X矩阵和Y变量之间的关系最大化,即可以使2组分类的差别达到最大,从而确定2组之间的化学差异成分[18]。为进一步确定蜜炙后代谢物的变化情况,采用OPLS-DA对水相、有机相组进行单独分析,得到OPLS-DA得分图(图 6-A-I、B-I)和S-VIP plot图(图 6-A-II、B-II)。图中“S”曲线中每一个点代表 1个变量,变量对分类的重要程度由VIP(variable importance in the projection)值的大小来衡量,变量离原点越远,VIP值越大。根据VIP值对变量进行筛选,VIP>0.6作为寻找差异代谢物候选物质。通过对款冬花蜜炙品和生品甲醇水相、氯仿相进行OPLS-DA分析(图 6-A-I、B-I),结果显示,蜜炙品和生品能明显分开。由图 6-A、B可知,对于甲醇水相提取物,款冬花蜜炙后1-O-乙基-β-D-葡萄糖苷、胆碱、α-葡萄糖、β-葡萄糖、蔗糖、芦丁的量上升,天冬氨酸、乙酸、苹果酸、缬氨酸等的量下降;款冬花蜜炙后氯仿相中款冬酮、β-谷甾醇的量上升,EMDNT、脂肪酸的量下降。
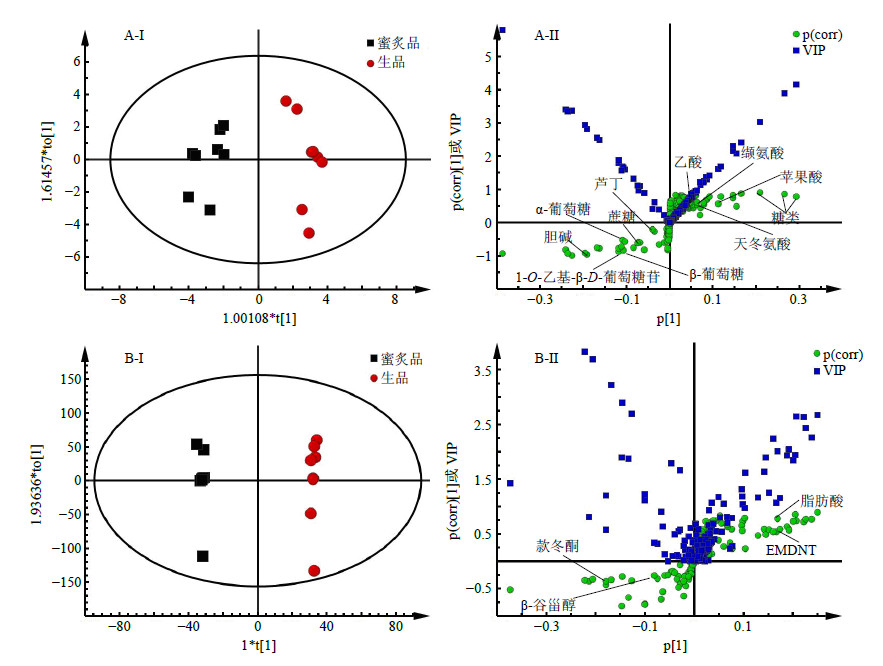 | 图 6 水相 (A) 和有机相 (B) 的OPLS-DA得分图 (I) 和S-VIP plot (II)Fig.6 OPLS-DAscoreplot(I) and S-VIP plot (II) of aqueous phase (A) and organic phase (B) |
以TSP或TMS为内标,选取指认出的化合物中特征峰明显,且与其他物质重叠峰小的27种成分进行手动积分,结果见表 2。款冬花生品与蜜炙品中1-O-乙基-β-D-葡萄糖苷、β-葡萄糖、蔗糖、α-葡萄糖、缬氨酸、天冬氨酸、苏氨酸、款冬酮、芦丁、绿原酸的量具有统计学差异,虽然胆碱、EMDNT等成分在生品与蜜炙品间无统计学差异,但可以看到,蜜炙后胆碱具有升高的趋势,而EMDNT、柠檬酸具有降低的趋势。结果与多元统计分析结果基本一致。
| 表 2 款冬花生品、蜜炙品代谢物和炼蜜相对峰面积比较 Table 2 Comparison on relative peak areas of metabolites among HFF, RFF, and refined honey |
蜜炙后款冬花中葡萄糖、果糖、1-O-乙基-β-D-葡萄糖苷的量升高,原因可能在于吸收了炼蜜中的这些成分;蔗糖、款冬酮、芦丁的量也明显增高,炼蜜中蔗糖的量很低,且不含款冬酮和芦丁,因此这些成分的变化需要进一步深入研究;4,5-二咖啡酰基奎尼酸、3,5-二咖啡酰基奎尼酸等咖啡酸类成分在生品和蜜炙品间无统计学差异,但有一定的降低趋势,原因可能在于这类成分含有酯键,在蜜炙后炒制过程中有一定程度的分解;虽然炼蜜中含有少量的苏氨酸、乙酸、琥珀酸,但款冬花中这些成分蜜炙后其量降低,其原因需进一步探究。
3 讨论蜜炙是中药材常用的炮制手段之一,对中药药效的发挥有重要意义。深入揭示中药蜜炙的科学内涵有助于建立规范化的中药材炮制工艺,对于中医药现代研究和保证临床用药的安全有效具有重要意义。本研究采用NMR技术对款冬花生品和蜜炙品进行了化学比较,通过多元统计分析和单变量分析结合的方法可以看出,款冬花蜜炙后包括初级代谢产物和次级代谢产物在内的多种成分的量均发生了变化。蜜炙品中次级代谢产物如款冬酮、芦丁等质量分数升高,而3,5-二咖啡酰基奎尼酸、3,4-二咖啡酰基奎尼酸等质量分数降低。本课题组前期通过对款冬花化学成分和止咳化痰活性的相关性分析结果显示[19],3,5-二咖啡酰基奎尼酸、芦丁以及款冬酮等倍半萜物质与款冬花的止咳化痰活性相关性较大。本研究结果显示,芦丁、款冬酮的量在蜜炙后呈上升趋势,但咖啡酰基奎尼酸类成分却呈现下降趋势。因此,这一类成分在款冬花止咳化痰功效中发挥的贡献作用值得进一步深入研究。
除次级代谢产物之外,中药中还含有大量的初级代谢产物,如氨基酸、有机酸、糖类等。这类成分极性较大,而且大多没有紫外吸收,采用HPLC或液质联用难以检测。NMR是一种无选择性的分析技术,能检测几乎所有的含氢化合物,因此是检测这类成分的有效手段。本研究首次揭示了蜜炙对款冬花初级代谢产物的影响,这些初级代谢产物的变化与蜜炙增强款冬花止咳化痰功效的相关性也值得进一步深入研究。此外,款冬花中含有肝毒性吡咯里西丁类生物碱类成分[20],但由于核磁共振灵敏度较低,本研究中未检测到该类成分,蜜炙对款冬花中毒性成分的影响,需要进一步采用液质联用等手段进行分析。
| [1] | 米霞,李震宇,秦雪梅,等.基于NMR代谢组学技术的不同性状款冬花药材的化学比较 [J].药学学报, 2013, 48(11): 1692-1697. |
| [2] | 支海娟.基于NMR款冬植物代谢组学研究 [D].太原:山西大学, 2012. |
| [3] | 任群峰,刘天禄.款冬花蜜炙经验 [J].新疆中医药, 2000, 18(4): 46-47. |
| [4] | 韩超.款冬花蜜炙前后款冬酮的含量变化研究 [J].科技致富向导, 2013(23): 216. |
| [5] | 李红军,王增绘,李文涛,等. UPLC-Q-TOF/MS法分析款冬花蜜炙前后的化学成分变化 [J].中国药房, 2015, 26(6): 792-794. |
| [6] | 李震宇,李爱平,张福生,等.植物代谢组学技术在山西道地药材研究中的应用 [J].中草药, 2013, 44(7): 785-789. |
| [7] | 田栋,李震宇,范圣此,等.基于NMR代谢组学技术的不同产地黄芪水溶性浸出物化学组成分析 [J].药学学报, 2014, 49(1): 89-94. |
| [8] | 何盼,李震宇,张福生,等.基于代谢组学技术和ITS2序列的恒山黄芪与川黄芪差异性研究 [J].药学学报, 2013, 48(10): 1692-1697. |
| [9] | Jiang Y, Vaysse J, Gilard V, et al. Quality assessment of commercial Magnoliae officinalis Cortex by 1H NMR-based metabolomics and HPLC methods [J]. Phytochem Anal, 2012, 23(4): 387-395. |
| [10] | Yang S O, Shin Y S, Hyun S H, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages [J]. J Pharm Biomed Anal, 2012, 58(1): 19-26. |
| [11] | Chang W T, Chio Y H, Hhijden R V, et al. Traditional processing strongly affects metabolite composition by hydrolysis in Rehmannia glutinosa roots [J]. Pharm Soc Japan, 2011, 59(5): 546-552. |
| [12] | 王雪洁,李震宇,薛水玉,等.基于植物代谢组学技术的远志不同炮制品质量控制研究 [J].中草药, 2012, 43(9): 1727-1737. |
| [13] | 范玛莉,邢婕,李震宇,等.基于NMR代谢组学技术的白芍与赤芍化学成分比较研究 [J].中草药, 2014, 45(22): 3230-3237. |
| [14] | 那丽丹,陈建丽,秦雪梅,等.基于1H-NMR代谢组学的阿胶化学成分差异性分析方法初探 [J].中草药, 2015, 46(17): 2573-2579. |
| [15] | 李艺,范玛莉,邢婕,等.龟龄集中细辛特殊炮制工艺的代谢组学研究 [J].中草药, 2015, 46(16): 2385-2393. |
| [16] | 田俊生,那丽丹,向欢,等.基于核磁代谢组学的驴皮与其伪品的鉴别研究 [J].中草药, 2015, 46(2): 255-261. |
| [17] | Zhi H J, Qin X M, Sun H F, et al. Metabolic fingerprinting of Tussilago farfara L. using 1H NMR spectroscopy and multivariate data analysis [J]. Phytochem Anal, 2012, 23(5): 492-501. |
| [18] | 李爱平,李震宇,邢婕,等.核磁共振代谢组学技术检测食醋化学成分 [J].食品科学, 2013, 34(12): 247-253. |
| [19] | Li Z Y, Zhi H J, Zhang F S, et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis [J]. J Pharm Biomed Anal, 2013, 75: 158-164. |
| [20] | 陈雪园,张如松,杨苏蓓.款冬花化学成分及药理毒理研究进展 [J].亚太传统医药, 2012, 8(1): 173-174. |
 2015, Vol. 46
2015, Vol. 46


